
-

生物通官微
陪你抓住生命科技
跳动的脉搏
CIC::DUX4融合肉瘤中POLE上调与DNA修复能力增强的分子机制及治疗策略研究
【字体: 大 中 小 】 时间:2025年06月21日 来源:npj Precision Oncology 6.8
编辑推荐:
本研究针对CIC::DUX4易位阳性肉瘤(CDS)化疗耐药性强、缺乏有效治疗方案的临床难题,通过多组学分析揭示了POLE基因异常激活与DNA修复通路增强的关键作用。研究人员发现CDS特有的五基因特征(POLE/ETV1/4/5/DUSP4)驱动肿瘤高增殖和基因组稳定性,并筛选出venetoclax等潜在靶向药物,为这一罕见肉瘤的精准治疗提供新思路。
在儿童和青少年高发的恶性软组织肿瘤中,CIC::DUX4易位阳性肉瘤(CDS)因其侵袭性强、化疗反应差而备受关注。这类被归类为"小圆蓝细胞肿瘤"的罕见肉瘤,五年生存率显著低于其他同类肿瘤。尽管CIC::DUX4融合基因已被确认为其分子标志,但驱动其恶性表型的下游机制始终成谜,导致临床缺乏针对性治疗策略。传统化疗方案对CDS效果有限,患者常面临"无药可用"的困境,这促使科学家们必须深入解析其分子特征以寻找新的治疗靶点。
美国佛罗里达大学药学院Nathan D. Seligson团队联合Tempus AI公司研究人员,在《npj Precision Oncology》发表了突破性研究成果。他们整合分析了39例CDS患者的基因组数据和多个独立数据集,首次发现DNA聚合酶ε(POLE)的异常高表达与DNA修复通路激活是CDS的分子特征。这种独特的生物学特性不仅解释了肿瘤的高增殖和耐药现象,更意外地揭示了靶向BCL-2的venetoclax可能成为潜在治疗选择。
研究采用多平台技术联合作战:从Tempus AI数据库获取临床样本的靶向DNA测序(648基因)和全转录组数据;整合GEO中14个独立数据集的微阵列和RNA-seq结果;运用单样本基因集富集分析(ssGSEA)评估DNA修复通路活性;通过癌症细胞系百科全书(CCLE)筛选药物敏感性关联。所有分析均经过严格的多重验证,包括患者样本、细胞系模型和动物实验的三重证据链支持。
【基因组特征揭示CDS的"寂静"景观】
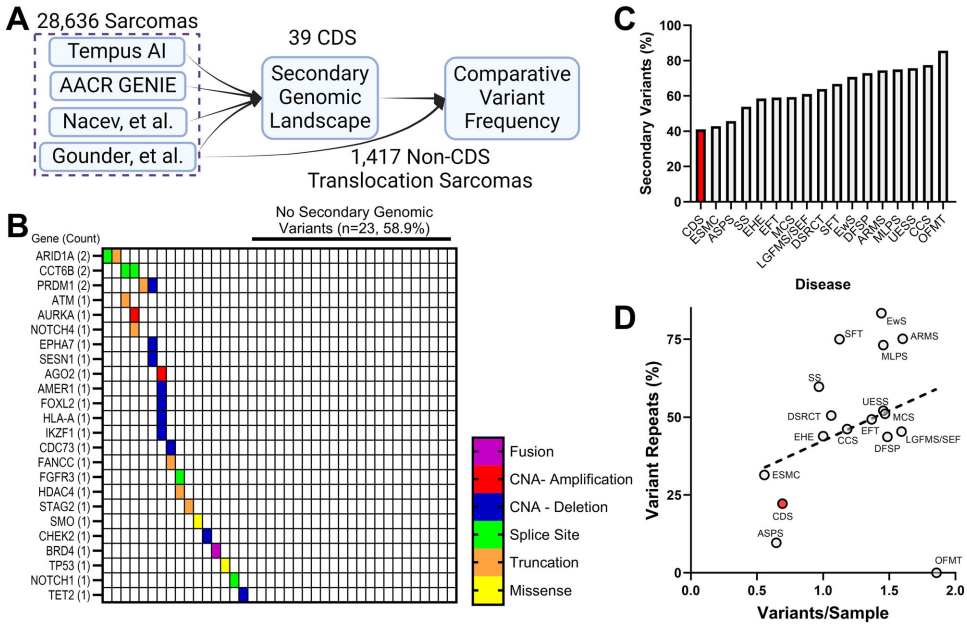
分析28,636例肉瘤的基因组数据发现,CDS具有全瘤种最低的突变负荷(中位数0.8 mut/Mb),仅41%病例存在伴随突变。引人注目的是,ARID1A等与化疗耐药相关的基因变异虽零星出现,但缺乏重现性模式。通路分析显示,抵抗细胞死亡(q=3.8×10-8)和基因组不稳定性(q=5.1×10-8)相关基因显著富集,暗示CDS可能通过非突变机制维持基因组稳定。
【五基因转录特征锁定CDS分子指纹】
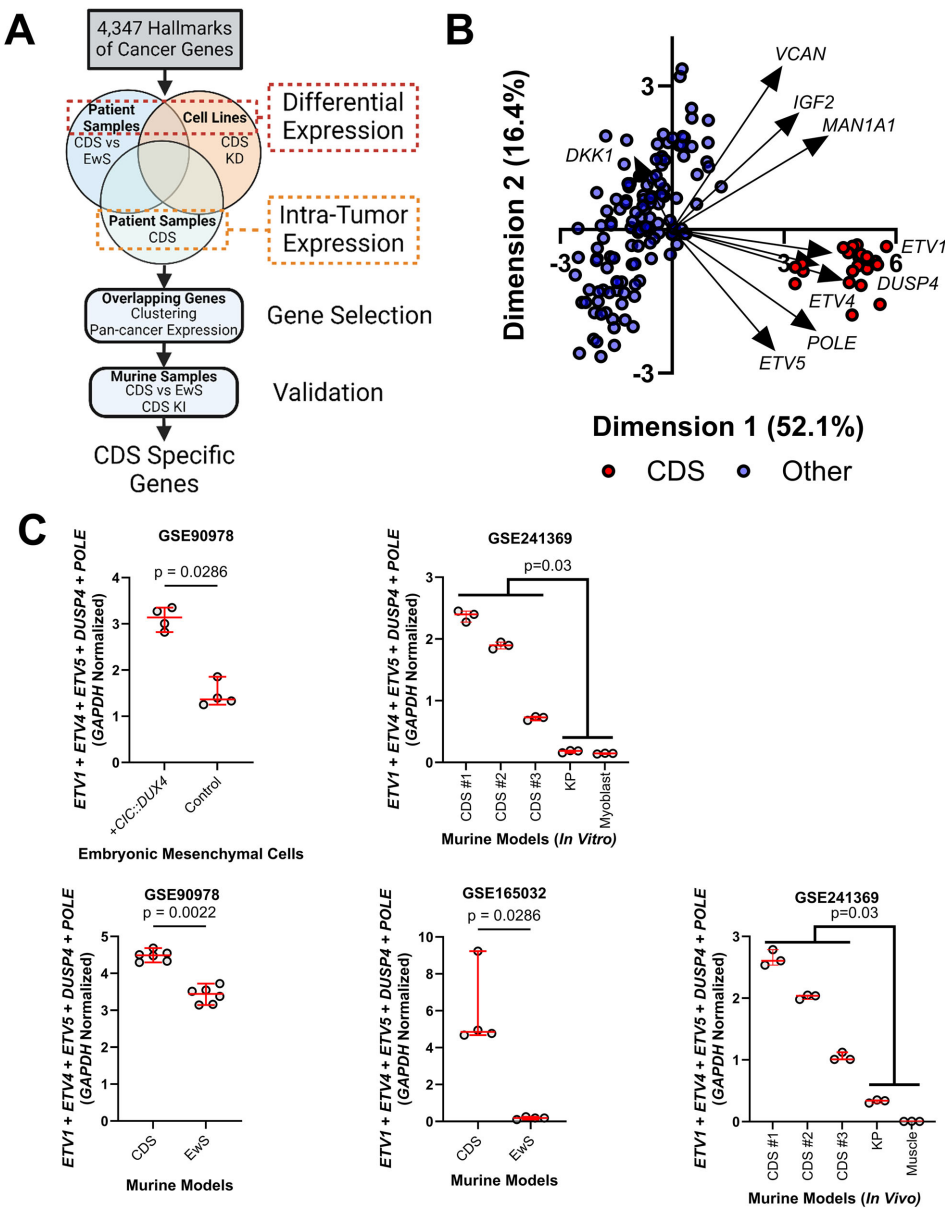
研究人员创新性地交叉比对了患者肿瘤、CIC::DUX4敲除细胞系和异种移植模型数据,最终提炼出POLE、ETV1/4/5和DUSP4组成的诊断标志物组合。其中POLE的表达水平与增殖标志物MKI67呈现强相关性(r2=0.83),在15,353例泛癌分析中展现出CDS特异性。这一发现首次将DNA复制核心元件与CDS的生物学特性联系起来。
【DNA修复网络异常激活的临床意义】
单样本通路分析揭示,CDS中同源重组修复(HR)等DNA修复通路活性显著高于尤文肉瘤(EwS)。特别值得注意的是,POLE作为高保真DNA复制酶,其过表达可能抵消肿瘤高速增殖导致的复制压力。这种"双刃剑"效应使得CDS既能维持基因组稳定抵抗内源性损伤,又能耐受化疗药物诱导的DNA断裂——这可能是其化疗抵抗的关键机制。
【药物敏感性筛选指明治疗新方向】
基于GDSC数据库的关联分析带来意外发现:高表达POLE的肿瘤对BCL-2抑制剂venetoclax敏感。这与既往观察到CDS中BCL-2高表达的现象相吻合。同时,ETV家族基因高表达与ERK/MEK抑制剂敏感性相关,但作者指出由于DUSP4对ERK信号的负调控作用,该通路可能并非理想靶点。
这项研究重塑了人们对CDS分子机制的认识:CIC::DUX4融合通过同时激活ETV转录因子(驱动增殖)和POLE-DNA修复轴(维持稳定),创造出独特的致癌环境。这种"高速复制-精密修复"的恶性循环,恰是临床治疗需要突破的关键环节。
研究提出的"POLE高表达-基因组稳定-化疗抵抗"理论模型,为理解其他高增殖肿瘤的耐药机制提供了新范式。更重要的是,发现venetoclax的潜在疗效将加速靶向治疗的临床转化。鉴于CDS患者多为年轻群体,这项研究的社会意义尤为重大——它让"无药可医"的罕见肿瘤患者首次看到了精准治疗的曙光。
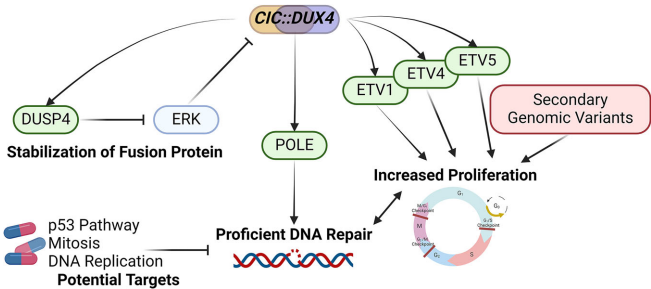
未来研究需要解决几个关键问题:POLE是否直接受CIC::DUX4调控?其催化活性还是非经典功能起主要作用?在动物模型中验证venetoclax疗效的可靠性如何?回答这些问题将推动CDS治疗进入分子靶向新时代。
 生物通微信公众号
生物通微信公众号
知名企业招聘