
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Y2O3纳米颗粒通过ROS线粒体P53通路诱导胰腺癌细胞选择性凋亡的机制研究
【字体: 大 中 小 】 时间:2025年06月21日 来源:Scientific Reports 3.8
编辑推荐:
本研究针对胰腺癌治疗中存在的毒性高、选择性差等难题,首次探索了Y2O3-NPs对PANC-1细胞的抗癌机制。研究发现Y2O3-NPs能以IC50 31.06μg/ml选择性杀伤癌细胞,通过激活ROS-p53通路引发DNA损伤和线粒体功能障碍,为胰腺癌靶向治疗提供了新策略。
胰腺癌被称为"癌中之王",其五年生存率不足10%,传统化疗面临毒性大、易耐药等瓶颈。纳米技术的兴起为这一难题带来曙光,其中氧化钇纳米颗粒(Y2O3-NPs)因其独特的抗氧化与促氧化双重特性备受关注。开罗大学和十月现代科学与艺术大学的研究团队在《Scientific Reports》发表的研究,首次系统揭示了Y2O3-NPs对胰腺癌细胞的"双刃剑"作用机制。
研究采用SRB法检测细胞活力,通过彗星实验评估DNA损伤,结合DCFH-DA荧光探针和罗丹明123染色分别检测ROS水平和线粒体膜电位,并运用流式细胞术和qRT-PCR分析凋亡率及相关基因表达。
Y2O3-NPs选择性杀伤癌细胞
实验显示Y2O3-NPs对PANC-1细胞的IC50值(31.06μg/ml)显著低于正常HSF细胞(319.21μg/ml),选择性指数达10.27,证实其靶向杀伤特性。
ROS风暴引发基因组危机
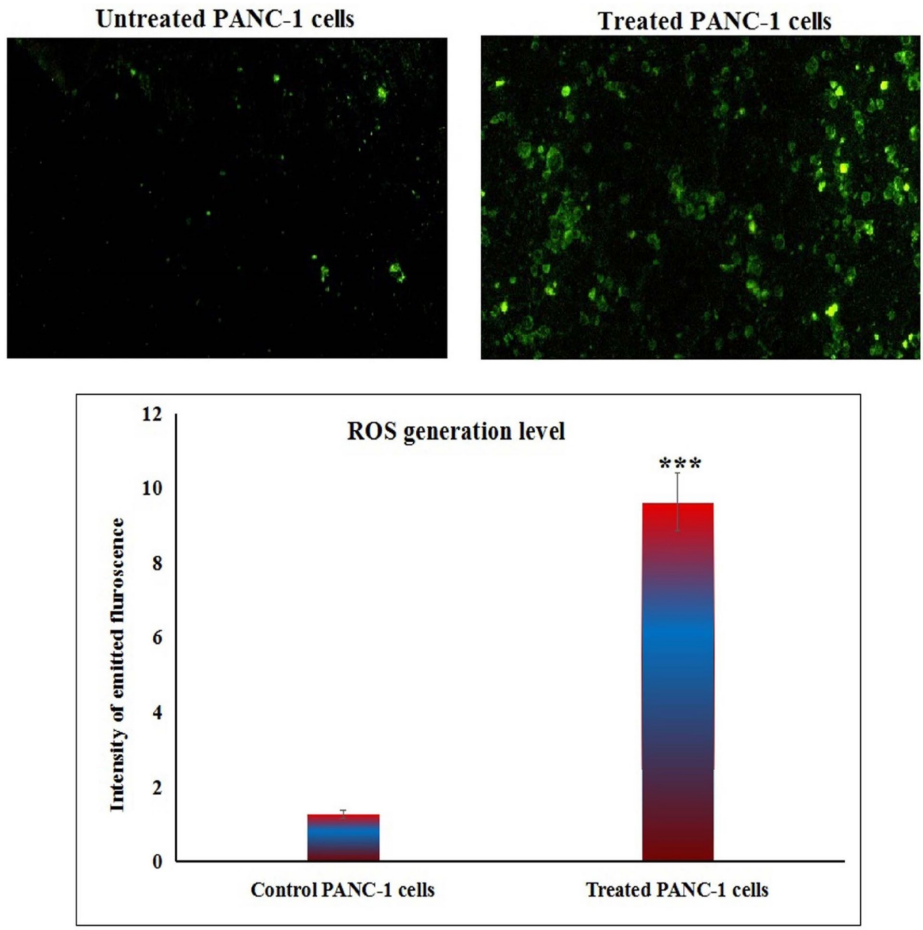
线粒体凋亡通路激活
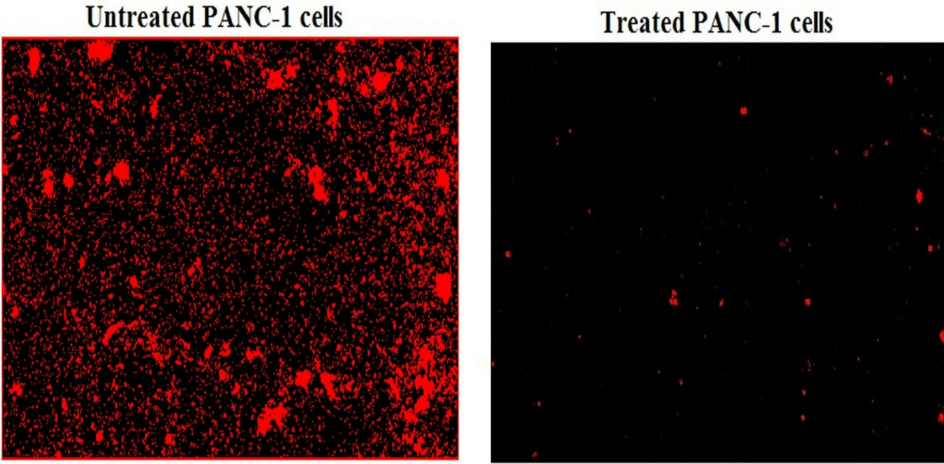
这项研究创新性地揭示了Y2O3-NPs通过"氧化应激-基因组损伤-线粒体凋亡"级联反应靶向清除癌细胞的分子机制,其高达10倍的选择性为克服传统化疗毒性提供了新思路。特别值得注意的是,该研究首次发现Y2O3-NPs能特异性激活ND3基因,这为开发基于线粒体呼吸链复合物的新型抗癌靶点提供了理论依据。未来研究需进一步探索Y2O3-NPs在动物模型中的递送效率和生物分布特性,以及与其他靶向药物的协同效应。
 生物通微信公众号
生物通微信公众号
知名企业招聘