
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:靶向调节性细胞死亡在NAFLD/NASH阶段治疗肝细胞癌的综合视角
【字体: 大 中 小 】 时间:2025年06月21日 来源:Cell Death Discovery 6.1
编辑推荐:
这篇综述深入探讨了非酒精性脂肪性肝炎(NASH)相关肝细胞癌(HCC)的发病机制,系统阐述了凋亡(apoptosis)、坏死性凋亡(necroptosis)、焦亡(pyroptosis)、铁死亡(ferroptosis)和铜死亡(cuproptosis)等调节性细胞死亡(RCD)途径在疾病进展中的关键作用,并全面总结了靶向RCD通路的新型治疗策略及其临床转化前景。
NAFLD/NASH-HCC的病理机制演进
非酒精性脂肪性肝炎(NASH)作为非酒精性脂肪肝病(NAFLD)的炎症亚型,其典型病理特征包括脂肪变性、肝细胞气球样变、小叶炎症和纤维化。随着代谢紊乱的持续发展,NASH可通过慢性炎症过程促进致癌微环境形成,最终导致终末期肝病包括肝细胞癌(HCC)和肝功能衰竭。值得注意的是,约30%-40%的NASH相关HCC发生在非肝硬化患者中,使其成为非肝硬化HCC的首要病因。
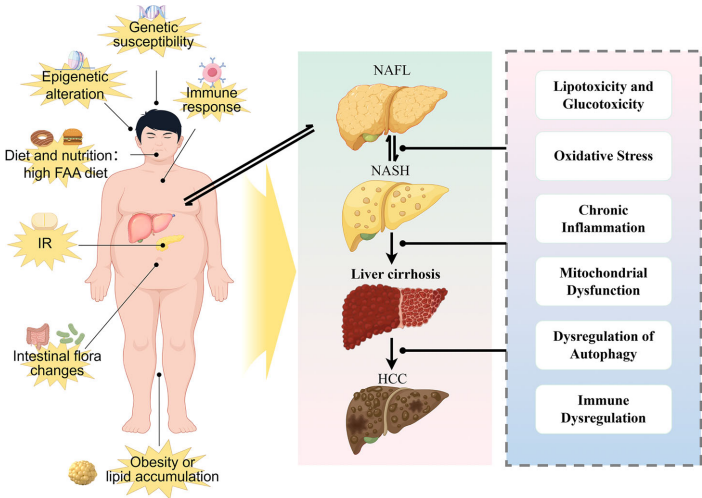
RCD的核心作用机制
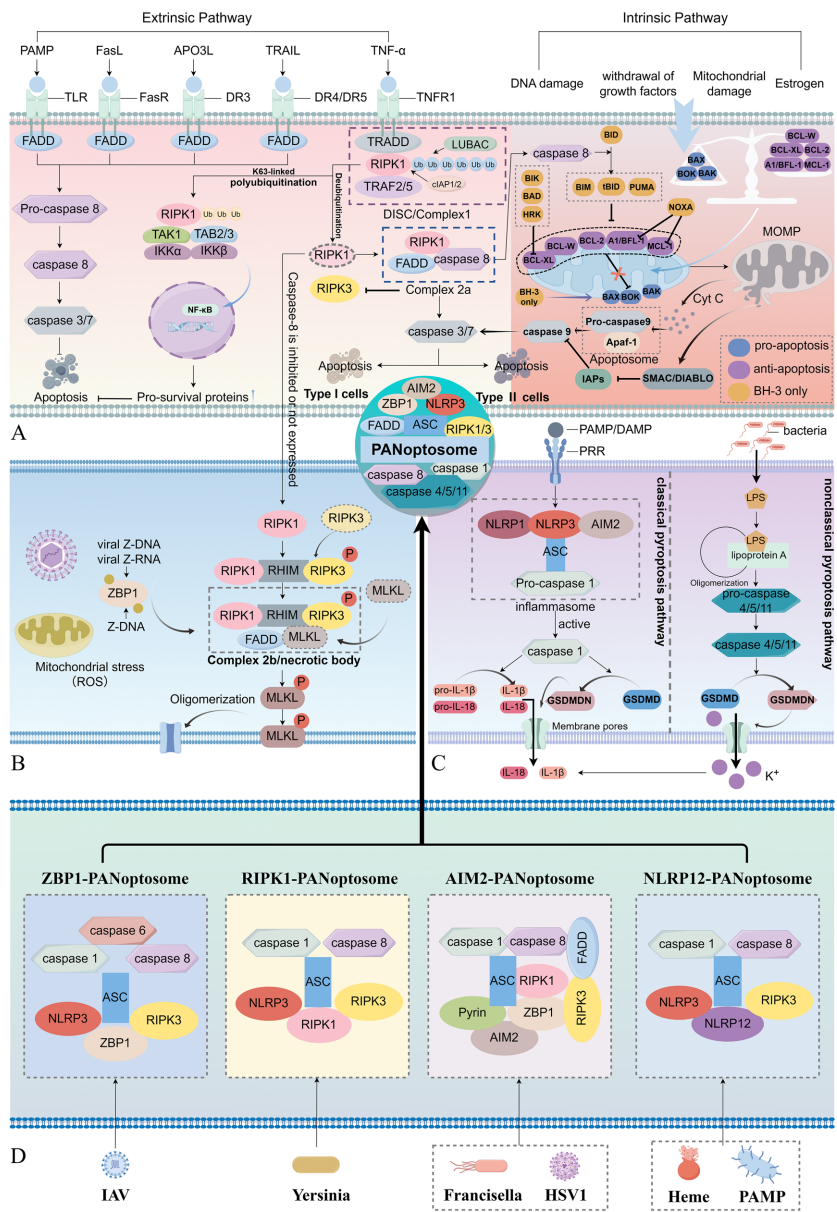
调节性细胞死亡(RCD)在NAFLD/NASH向HCC转化过程中扮演双重角色。在健康肝脏中,RCD是维持组织稳态的重要机制;而在病理状态下,氧化应激和内质网应激触发的异常细胞死亡成为疾病进展的驱动力。目前已发现12种RCD形式,包括凋亡、焦亡、坏死性凋亡、铁死亡、铜死亡等,各具独特的形态学特征和免疫调节功能。
凋亡通路的两大途径:
• 线粒体途径(内源性):由Bcl-2蛋白家族调控线粒体外膜通透性(MOMP),细胞色素c释放形成凋亡小体
• 死亡受体途径(外源性):通过FasR/TNFR1等受体激活caspase-8,进而激活执行者caspase-3/7
坏死性凋亡的分子开关:
当caspase-8被抑制时,RIPK1-RIPK3-MLKL形成坏死小体,磷酸化MLKL形成膜孔导致细胞内容物释放。值得注意的是,人类原代肝细胞中RIPK3的表观遗传沉默可能限制其坏死性凋亡能力。
焦亡的炎症风暴:
分为经典(caspase-1/GSDMD)和非经典(caspase-4/5/11)途径,特征性表现为gasdermin蛋白形成质膜孔道,伴随IL-1β/IL-18等促炎因子释放。NLRP3炎症小体激活是NASH的关键特征,其抑制剂MCC950已显示出治疗潜力。
铁死亡的代谢基础:
由铁依赖性脂质过氧化驱动,核心调控轴包括:
铜死亡的新发现:
铜超载通过FDX1介导的DLAT乙酰化和Fe-S簇蛋白降解引发细胞死亡。值得注意的是,锌转运体ZnT1新近被确认为Cu2+进入细胞的介质。
PANoptosis的整合概念:
ZBP1-PANoptosome等复合物可同时启动凋亡、坏死性凋亡和焦亡,为多靶点干预提供理论依据。中药四物汤通过抑制mtDNA转移减轻肝细胞PANoptosis的发现,为传统药物现代化研究提供范例。
治疗策略的创新突破
靶向凋亡通路:
• ASK1抑制剂selonsertib(GS-4997)进入III期临床
• 泛caspase抑制剂emricasan显著降低ALT水平
• SGLT2抑制剂通过调节Bcl-2/Bax比例发挥保肝作用
调控坏死性凋亡:
RIPK1抑制剂necrostatin-1s改善纤维化
RIPK3抑制剂GSK-872通过Nrf2/NF-κB轴减轻氧化应激
MLKL缺失抑制TGF-β/Smad2/3通路改善纤维化
干预焦亡途径:
维生素D抑制NLRP3炎症小体
VX-765阻断p-STAT3/ANXA2轴
circSOD2/miR-532-3p/TXNIP网络成为RNA治疗靶点
铁死亡精准干预:
铁螯合剂DFP减轻肝损伤
iGPX4亚型选择性抑制
MCU-siRNA阻断mtROS-NRF2信号传导
铜死亡调控探索:
FDX1作为NASH-HCC转化的关键分子
CTR1表达受MYC转录调控
DATs通过RAB18相分离选择性诱导HSC铜死亡
临床转化挑战与展望
当前NAFLD/NASH治疗面临三大瓶颈:
未来发展方向应关注:
• 单细胞测序解析RCD的细胞特异性
• CRISPR筛选鉴定关键调控节点
• 纳米递药系统实现肝靶向治疗
• 多靶点联合干预策略
中药复方(如四物汤)和天然化合物(如姜黄素)通过多通路协同作用展现独特优势。肠道菌群调控和表观遗传修饰作为新兴领域,可能为RCD靶向治疗提供突破方向。随着PANoptosis和铜死亡等新机制的深入研究,NAFLD/NASH-HCC的治疗格局有望迎来革命性变化。
 生物通微信公众号
生物通微信公众号
知名企业招聘