
-

生物通官微
陪你抓住生命科技
跳动的脉搏
克隆造血作为遗传学与阿尔茨海默病抗病力的交汇点:机制探索与临床转化前景
【字体: 大 中 小 】 时间:2025年06月21日 来源:npj Dementia
编辑推荐:
本文推荐:研究人员针对阿尔茨海默病(AD)保护机制的空缺,探索了克隆造血(CHIP)这一体细胞突变现象与AD抗病力的关联。通过多队列分析发现CHIP携带者AD风险降低(OR=0.64),揭示了骨髓来源突变髓系细胞可能通过补偿小胶质细胞功能障碍发挥保护作用。该研究为AD的多组学机制研究和临床风险评估提供了新视角。
在老龄化社会背景下,阿尔茨海默病(AD)已成为全球公共卫生危机。尽管已知APOEε2等遗传变异具有保护作用,但其人群覆盖率有限(<2%),且机制研究多集中于家族性AD。与此同时,克隆造血(Clonal Hematopoiesis of Indeterminate Potential, CHIP)——一种与年龄相关的造血干细胞体细胞突变现象,虽已知会增加血液系统恶性肿瘤和心血管疾病风险,却在近期研究中意外显示出与AD发病风险的负相关性。这种看似矛盾的联系,为理解AD的免疫调节机制提供了全新切入点。
来自哥伦比亚和英国的研究团队在《npj Dementia》发表的研究,首次系统阐述了CHIP与AD保护效应的剂量依赖性关联。通过整合Framingham心脏研究、心血管健康研究和AD测序项目三大队列的5728例样本,结合单细胞染色质可及性测序(ATAC-seq)和神经病理分析,研究者发现:携带CHIP突变(尤其是DNMT3A、TET2基因)的个体,其AD风险显著降低,且保护效应随变异等位基因频率(VAF)升高而增强。更关键的是,在脑组织中发现30-95%的微胶质样细胞携带与外周血相同的突变,提示骨髓来源的突变髓系细胞可能通过血脑屏障迁移,补偿衰老相关的神经炎症调控缺陷。
关键技术方法
研究采用多中心病例对照设计,纳入1362例AD患者和4368例对照,通过靶向测序检测CHIP相关突变(VAF>2%)。利用单细胞ATAC-seq分析6例CHIP携带者和4例非携带者的脑组织样本,鉴定突变细胞的转录特征。生物信息学分析包括孟德尔随机化验证因果关系,以及变异基因的染色质开放性比较。队列数据与Jack等人报告的AD生物标志物流行率进行跨研究比对,建立年龄分层模型。
研究结果
CHIP与AD风险的负相关性
三大独立队列的荟萃分析显示,CHIP携带者发生AD的比值比(OR)为0.64(P=3.8×10-5),且VAF每增加10%,保护效应提升18%。这种剂量效应模式与CHIP促进髓系细胞增殖的生物学特性一致。值得注意的是,DNMT3A突变(占检测变异的67%)的保护作用独立于其致白血病热点突变R882,提示表观遗传调控可能参与神经保护。
髓系细胞脑浸润的实证
通过对比外周血与脑组织的VAF相关性(r=0.89),以及突变细胞特有的PU.1转录因子表达特征,证实了骨髓来源细胞向脑实质的迁移。这些细胞表现出独特的染色质开放模式,不同于常驻小胶质细胞,但具有相似的吞噬溶酶体通路激活特征,可能增强β淀粉样蛋白(Aβ)清除能力。
临床时间窗模型
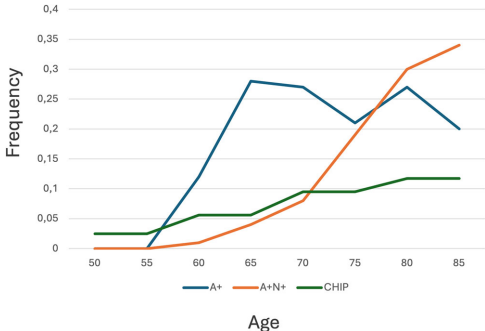
通过对比CHIP(10-30%≥50岁人群)与AD生物标志物的年龄分布,提出三个关键干预节点:57岁(A+病理早于CHIP流行)、70岁(A+N+病理早于CHIP)、77岁(A+N+超过A+单独)。
结论与展望
该研究建立了CHIP作为AD保护因子的多组学框架:体细胞突变→髓系细胞克隆扩增→脑实质迁移→代偿性神经炎症调节。其临床意义在于:① 将AD风险评估从生殖细胞变异扩展至体细胞突变领域;② 为靶向髓系细胞的免疫调节疗法(如增强DNMT3A突变细胞的归巢能力)提供新靶点;③ 推动CHIP检测纳入记忆门诊的预防性评估体系。
未来需解决的核心问题包括:CHIP突变细胞是否直接调节tau病理、如何平衡其心血管风险与神经保护效应,以及在不同族裔人群中的普适性验证。正如作者强调,这种"意外保护"现象再次证明,衰老相关疾病的机制研究需要跳出传统病因范式,在体细胞进化和免疫微环境动态交互中寻找答案。
 生物通微信公众号
生物通微信公众号
知名企业招聘