
-

生物通官微
陪你抓住生命科技
跳动的脉搏
成像引导的自放大光免疫治疗纳米颗粒通过STING通路激活增强癌症治疗
【字体: 大 中 小 】 时间:2025年06月22日 来源:Journal of Nanobiotechnology 10.6
编辑推荐:
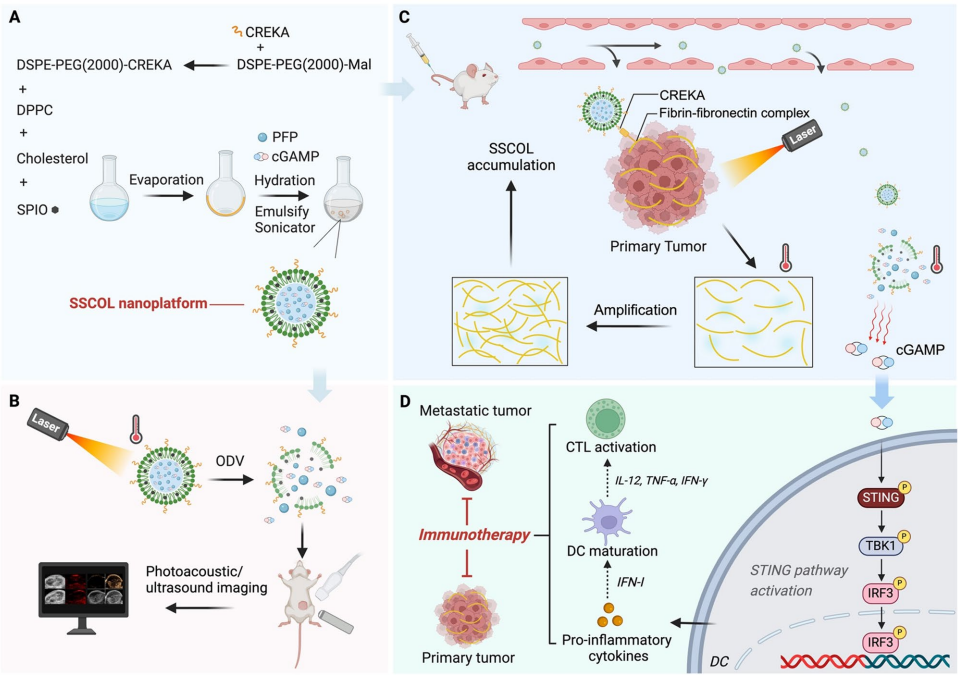
本研究针对当前STING通路靶向纳米药物存在的肿瘤特异性不足和免疫激活不充分两大难题,开发了一种新型成像引导的自放大光免疫治疗纳米颗粒(SSCOL)。该研究通过整合相变材料全氟戊烷(PFP)、光热剂超顺磁性氧化铁(SPIO)和STING激动剂cGAMP于脂质体框架中,结合肿瘤基质靶向肽CREKA,实现了光声/超声双模态成像引导下的精准治疗。创新性地利用光热效应诱导凝血级联放大靶点形成,建立了"光热诱导靶点放大-纳米颗粒自增强蓄积"的正反馈机制,显著提升了肿瘤靶向效率。同时通过光热触发相变控制cGAMP释放,有效激活cGAS-STING通路,促进树突状细胞(DC)成熟和细胞毒性T淋巴细胞(CTL)活化,对原发灶和转移灶均展现出显著治疗效果。这项研究为STING介导的癌症免疫治疗提供了多模态协同治疗新策略。
癌症转移和复发一直是临床治疗中的重大挑战。尽管免疫治疗通过激活抗肿瘤免疫展现出巨大潜力,但STING激动剂如环鸟苷酸-腺苷酸(cGAMP)的临床应用受到代谢稳定性差、细胞摄取效率低等限制。虽然纳米药物能改善STING激动剂的药代动力学,但仍面临逆转免疫抑制微环境、诱导强效系统免疫应答等挑战。与此同时,光热治疗(PTT)因其组织穿透深、可控性强等特点,成为协同癌症免疫治疗的有力选择。
针对这些关键科学问题,重庆医科大学附属第二医院的研究团队在《Journal of Nanobiotechnology》发表了一项创新研究。他们开发了一种成像引导的自放大光免疫治疗纳米颗粒(SSCOL),巧妙整合了相变材料全氟戊烷(PFP)、光热剂超顺磁性氧化铁(SPIO)和STING激动剂cGAMP,并通过肿瘤归巢肽CREKA实现精准靶向。这项研究创新性地提出了"光热诱导靶点放大"的正反馈机制,通过光热效应激活凝血级联反应,促进纤维蛋白-纤连蛋白复合物形成,从而为CREKA提供更多结合位点,实现了纳米颗粒的自增强蓄积。
研究团队主要采用了以下关键技术方法:(1)薄膜水化法制备多功能纳米颗粒;(2)光声/超声双模态成像技术实时监测纳米颗粒分布;(3)Transwell共培养系统评估树突状细胞成熟;(4)双侧4T1原位乳腺癌模型模拟原发灶和转移灶;(5)流式细胞术分析免疫细胞亚群变化。研究队列使用6-8周龄雌性BALB/c小鼠建立肿瘤模型。
纳米颗粒的制备与表征
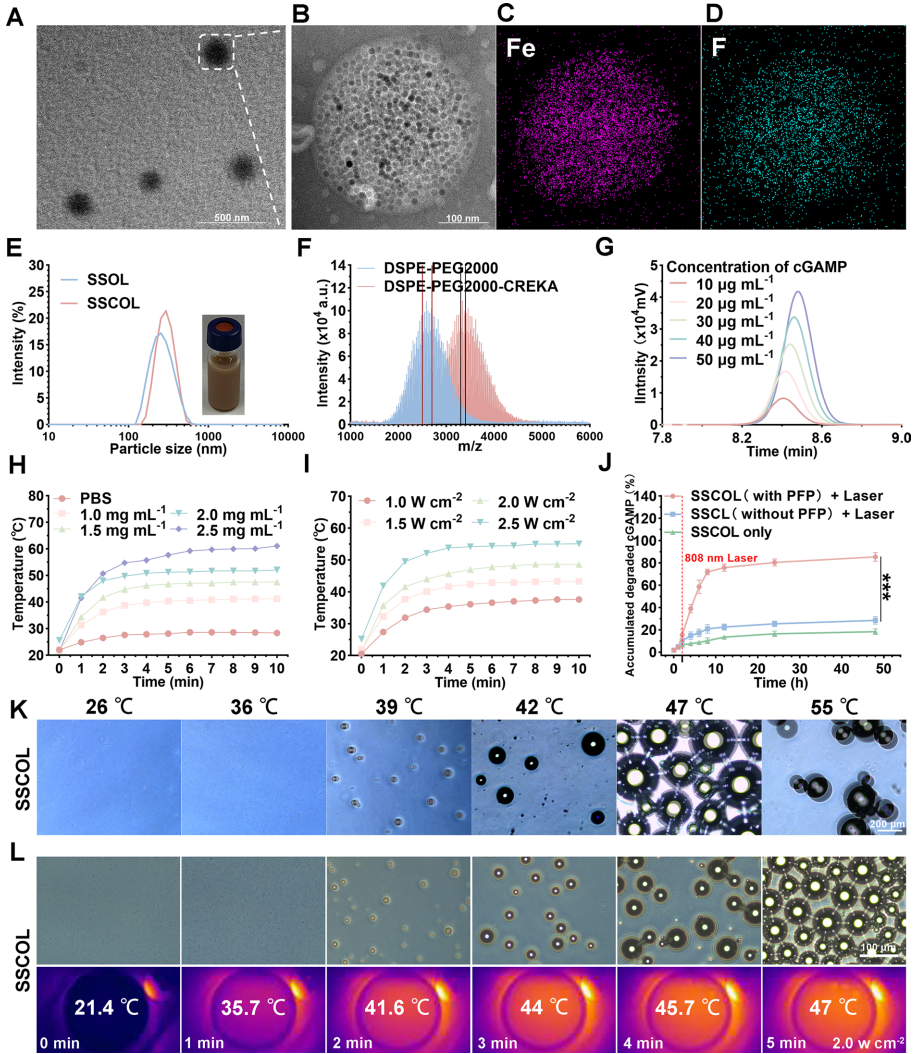
研究团队通过薄膜水化法成功制备了SSCOL纳米颗粒。透射电镜显示其具有均匀的球形形态,粒径约276nm,适合从血管外渗到肿瘤组织。元素分析证实了SPIO和PFP的成功包封。体外稳定性实验表明SSCOL在血清中能保持6天以上的稳定性。药物负载量测定显示每毫克SSCOL可负载382.5μg SPIO和267.3μg cGAMP。生物安全性评估证实SSCOL在600μg/mL浓度下对血管内皮细胞存活率无显著影响。
光热转换与相变性能
SSCOL展现出优异的光热转换效率,在808nm激光照射下,2.5mg/mL浓度可使温度升至61.1°C。相变性能研究表明,当温度超过PFP沸点29°C时,SSCOL会发生液气相变产生微泡,这一特性不仅实现了超声成像增强,还促进了cGAMP的控释。体外药物释放实验显示,激光照射可触发cGAMP的爆发式释放,2小时内释放量达60%以上。
肿瘤靶向与自放大效应
研究证实纤维蛋白-纤连蛋白复合物在肿瘤组织中特异性高表达。通过转化生长因子β(TGF-β)诱导上皮-间质转化(EMT),4T1细胞中纤连蛋白表达显著上调。体内分布实验显示,CREKA修饰使SSCOL在肿瘤部位的蓄积量显著高于非靶向组。更重要的是,光热治疗能激活凝血级联,促进纤维蛋白-纤连蛋白复合物形成,从而产生更多CREKA结合位点,形成"靶点放大-纳米颗粒蓄积"的正反馈循环。免疫荧光证实SSCOL与纤维蛋白-纤连蛋白复合物存在显著共定位。
双模态成像引导治疗
SSCOL展现出优异的光声/超声双模态成像性能。SPIO赋予纳米颗粒良好的光声对比能力,而PFP的激光触发相变则增强了超声回声信号。体内实验确定静脉注射后24小时为最佳治疗时间窗,此时肿瘤部位光声信号达到峰值。超声成像显示激光照射10分钟后,肿瘤部位回声强度显著增强,为精准治疗提供了可视化引导。
STING通路激活与免疫应答
体外实验证实,SSCOL在激光触发下释放的cGAMP能显著促进树突状细胞(DC)中干扰素(IFNb1、IFNa1)、肿瘤坏死因子(TNF)等细胞因子的表达。Western blot显示SSCOL+Laser处理组中STING、TBK1和IRF3的磷酸化水平显著升高。在双侧4T1肿瘤模型中,SSCOL联合PTT治疗显著提高了肿瘤和脾脏中成熟DC(CD11c+CD80+CD86+)的比例,并促进CD8+ T细胞浸润。免疫荧光显示治疗组原发灶和转移灶中均观察到强烈的CD8和IFN-γ信号。
抗肿瘤疗效评估
在双侧4T1乳腺癌模型中,SSCOL联合PTT展现出对原发灶和转移灶的协同抑制效果。H&E和TUNEL染色显示治疗组原发灶肿瘤细胞出现广泛坏死和凋亡,而PCNA染色显示转移灶增殖活性显著降低。值得注意的是,SSCOL+Laser组的治疗效果显著优于游离cGAMP联合PTT组,证实了纳米载体在增强免疫激活方面的优势。
这项研究通过精心设计的多功能纳米平台,成功解决了STING靶向纳米药物的两大关键挑战。创新性的"自放大靶向"机制显著提升了肿瘤特异性,而光热控释策略则确保了充分的免疫激活。研究不仅实现了成像引导的精准治疗,还通过协同激活先天免疫和适应性免疫,为癌症免疫治疗提供了新思路。这种整合诊断与治疗的多模态策略,为临床转化提供了有前景的技术路线。
 生物通微信公众号
生物通微信公众号
知名企业招聘