
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:靶向成纤维细胞活化蛋白α的蛋白质类放射性药物研究进展
【字体: 大 中 小 】 时间:2025年06月23日 来源:EJNMMI Radiopharmacy and Chemistry 4.4
编辑推荐:
这篇综述系统总结了靶向成纤维细胞活化蛋白α(FAPα)的蛋白质类放射性药物(包括单克隆抗体、抗体片段和单域抗体)近40年的研究进展,重点探讨了其在癌症诊断(PET/SPECT成像)和靶向放射治疗(如177Lu/225Ac标记)中的潜力,并分析了FAP在肿瘤微环境(TME)中的生物学作用及临床转化挑战。
成纤维细胞活化蛋白α(FAPα)是一种在良性组织中低表达但在多种病理状态(尤其是癌症)中过度表达的丝氨酸蛋白酶。作为肿瘤微环境(TME)中癌症相关成纤维细胞(CAFs)的标志物,FAPα通过参与细胞外基质(ECM)重塑、促肿瘤信号通路(如PI3K/AKT、RAS/ERK)和免疫抑制微环境形成,与肿瘤进展和不良预后显著相关。
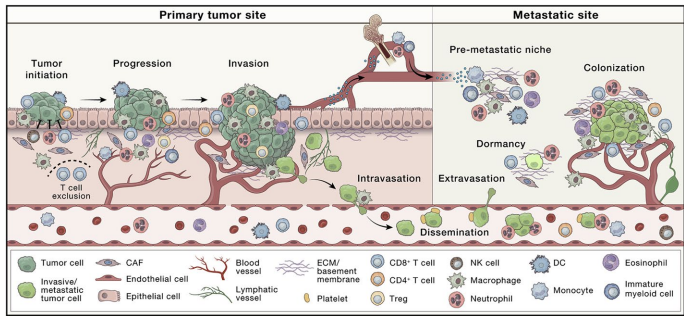
1986年Rettig团队首次开发出鼠源F19单抗,其放射性标记版本[131I]I-F19在结直肠癌肝转移模型中显示出9:1的肿瘤-血清比。后续人源化抗体sibrotuzumab虽改善了免疫原性,但仍存在剂量依赖性清除问题。近年来,新型抗体如ESC11(177Lu标记)和PKU-525(225Ac标记)通过优化内化效率,在黑色素瘤和乳腺癌模型中实现了显著肿瘤抑制。
源自骆驼科动物的单域抗体(sdAb/VHH)因其小分子量(15 kDa)和高组织穿透性成为研究热点。例如:
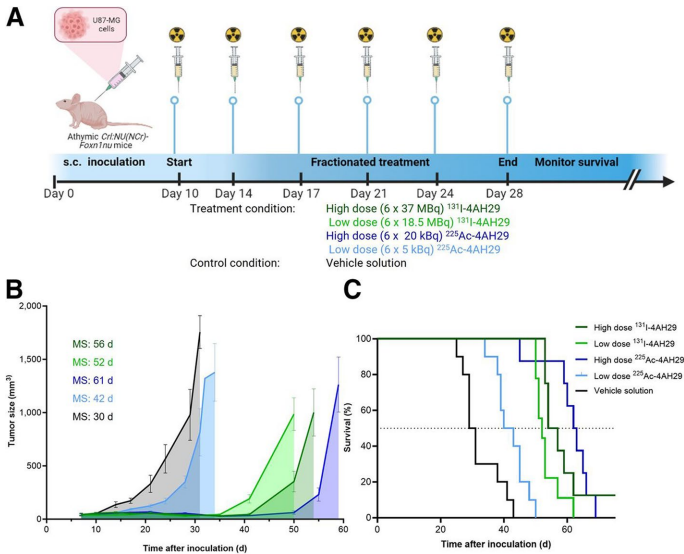
当前局限性包括:
未来方向聚焦于:
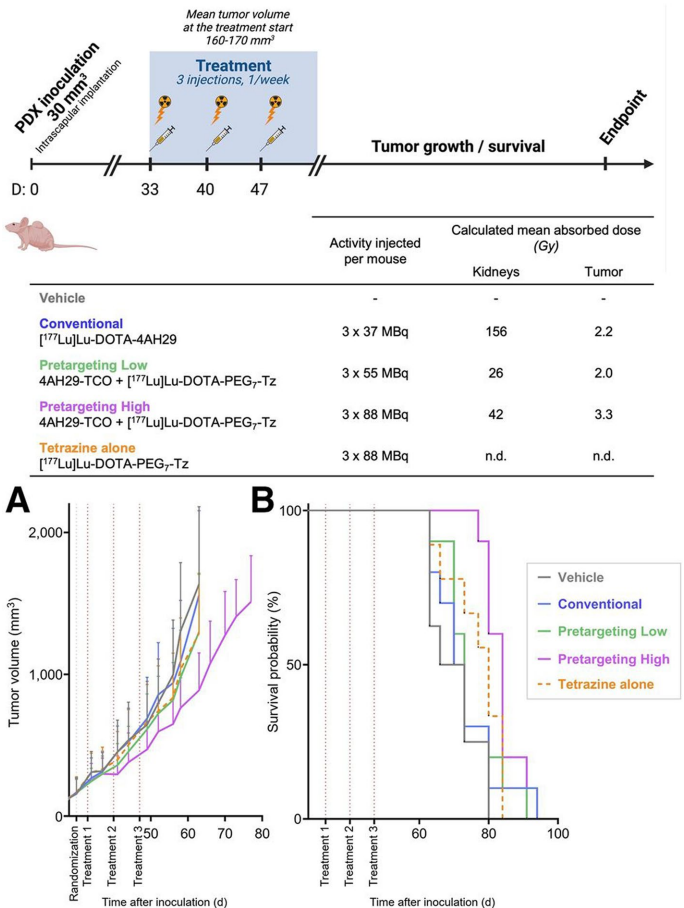
该领域正从单纯的显像工具向"诊疗一体化"(theranostics)范式转变,为突破实体瘤治疗瓶颈提供了新思路。
 生物通微信公众号
生物通微信公众号
知名企业招聘