
-

生物通官微
陪你抓住生命科技
跳动的脉搏
甲状腺癌分子分型与预后预测的多组学整合分析及机器学习模型构建
【字体: 大 中 小 】 时间:2025年06月25日 来源:Discover Oncology 2.8
编辑推荐:
本研究针对甲状腺癌(THCA)分子异质性导致的预后和治疗难题,通过整合基因组、转录组、表观组等多组学数据,应用11种聚类算法鉴定出3种具有显著预后差异的分子亚型(CS1-CS3)。基于稳定预后相关基因(SPRGs),采用99种机器学习组合构建了共识机器学习驱动标志物(CMLS),在多个队列验证中展现出优越的预后预测性能,同时揭示了免疫微环境特征与治疗敏感性关联,为甲状腺癌精准诊疗提供了新工具。
甲状腺癌作为内分泌系统最常见的恶性肿瘤,近年来发病率持续攀升。虽然90%的病例属于预后较好的分化型甲状腺癌,但仍有10-30%患者面临复发转移的困境。更棘手的是,这种疾病展现出显著的分子异质性,使得传统分类方法难以准确预测个体预后,也导致免疫治疗等新型疗法响应率参差不齐。面对这些临床挑战,中山大学附属第三医院等机构的研究团队在《Discover Oncology》发表了一项突破性研究。
研究团队创新性地整合了五种组学数据维度:包括全转录组(mRNA/lncRNA/miRNA)、DNA甲基化、体细胞突变等,采用11种先进的聚类算法进行共识分析。关键技术包括:通过MOVICS软件包进行多组学整合聚类;使用KNN算法处理缺失值;采用z-score标准化数据;运用随机生存森林(RSF)等10种机器学习方法构建预后模型;通过GSVA进行通路富集分析;利用ESTIMATE和IOBR评估免疫浸润特征。所有分析均基于TCGA-THCA队列,并经过多个外部免疫治疗队列验证。
多组学共识聚类与预后分层
研究首先通过整合十种聚类算法,确定了三个具有显著预后差异的分子亚型(CS1-CS3)。CS2亚型表现出最差的临床结局,且与BRAF基因高频突变相关。这一发现为理解甲状腺癌的分子异质性提供了新视角。

肿瘤微环境与分子特征
深入分析显示,不同亚型具有独特的免疫景观。CS2和CS3表现出免疫检查点基因上调和EMT通路激活,提示潜在的免疫治疗敏感性。值得注意的是,各亚型对性激素的反应存在差异:CS1对雄激素敏感,而CS2/CS3则更响应雌激素刺激。

CMLS模型的构建与验证
研究团队从候选基因中筛选出9个关键基因,构建了共识机器学习驱动标志物(CMLS)。该模型在训练集和验证集中均展现出优异的预后预测能力,C-index显著优于既往报道的22种标志物。高风险组(CMLS-high)患者表现出更差的生存结局。

免疫基因组学特征
尽管CMLS-high组具有更高的肿瘤突变负荷(TMB)和新生抗原负荷(TNB),但其肿瘤微环境却呈现"冷肿瘤"特征,表现为CD8+T细胞和M1型巨噬细胞浸润减少。这种矛盾现象提示了复杂的免疫逃逸机制。

治疗响应预测
在IMvigor210等免疫治疗队列中,CMLS-low患者显示出更好的治疗响应和生存获益。相反,CMLS-high患者可能更适合化疗药物如多西他赛。这一发现为临床治疗决策提供了重要参考。
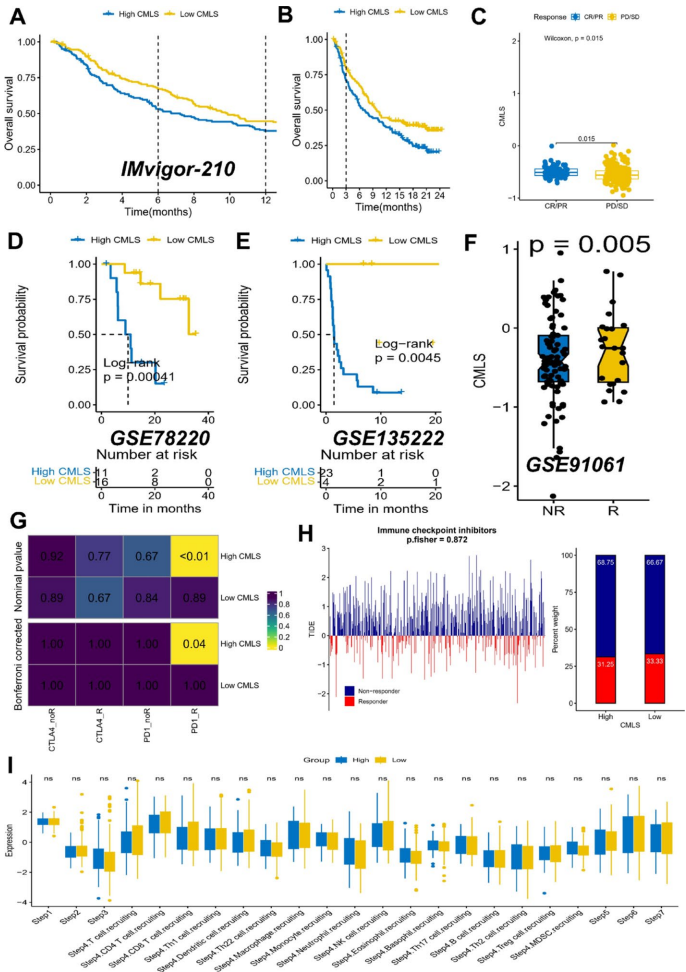
这项研究通过创新的多组学整合策略,建立了甲状腺癌分子分型新体系,并开发出具有临床转化潜力的CMLS预后模型。该工作的重要意义体现在三个方面:首先,多算法共识分析显著提高了分子分型的可靠性;其次,CMLS模型在多个独立队列中验证了其稳健性;最后,研究揭示了预后差异背后的免疫微环境机制,为个体化治疗提供了理论依据。特别是发现的亚型特异性治疗敏感性模式,有望指导临床实践中的精准用药选择。虽然仍需前瞻性研究验证,但这项工作无疑为改善甲状腺癌患者管理提供了重要的分子工具和理论基础。
 生物通微信公众号
生物通微信公众号
知名企业招聘