
-

生物通官微
陪你抓住生命科技
跳动的脉搏
肠道菌群与儿童发育迟缓的关联研究:基于无菌猪模型的微生物组移植与功能分析
【字体: 大 中 小 】 时间:2025年06月27日 来源:Gut Pathogens 4.4
编辑推荐:
本研究针对营养不良导致的儿童发育迟缓问题,通过比较健康与发育迟缓幼儿的肠道菌群差异,并建立无菌猪(Gn)粪便移植模型,揭示了发育迟缓相关菌群的结构与功能特征。研究发现发育迟缓幼儿肠道中变形菌门(Proteobacteria)富集,而健康幼儿以放线菌门(Actinobacteria)为主;通过宏基因组分析发现发育迟缓菌群的碳水化合物合成酶(CAZymes)和分解代谢通路增强,而健康菌群以降解酶和合成代谢为主。该研究首次证明发育迟缓相关菌群特征可在动物模型中稳定传递,为微生物组干预提供了新思路。
研究背景与意义
全球范围内,营养不良是导致儿童发病和死亡的主要原因之一,尤其在低收入和中等收入国家更为突出。发育迟缓(stunting)作为长期营养不良的严重后果,不仅影响儿童体格发育,还与认知功能障碍和代谢疾病风险增加密切相关。尽管营养干预措施不断改进,但传统方法对发育迟缓的改善效果有限,这促使科学家将目光转向肠道微生物组——这个被称为"第二基因组"的复杂生态系统。
近年研究表明,肠道菌群通过调节营养吸收、免疫发育和能量代谢等多种途径影响宿主健康。然而,发育迟缓与肠道菌群之间的因果关系仍不明确,部分原因是缺乏合适的动物模型来研究这种复杂互作。常规啮齿类动物模型与人类在解剖学和生理学上存在显著差异,而无菌(germ-free, GF)猪模型因其胃肠道结构和免疫系统与人类高度相似,成为研究人类微生物组的理想平台。
研究方法概述
肯尼亚国立医院收集了12-24月龄健康(n=3)和发育迟缓(n=3)幼儿的粪便样本,通过全基因组测序分析菌群组成和功能差异。随后将代表性样本移植到无菌猪(Gn pig)模型,持续观察23天。采用CosmosID-HUB平台进行宏基因组数据分析,包括α/β多样性、细菌分类组成、毒力因子、抗菌素耐药性(AMR)基因和代谢通路(如CAZymes)等功能特征。
主要研究结果
微生物组成与多样性差异
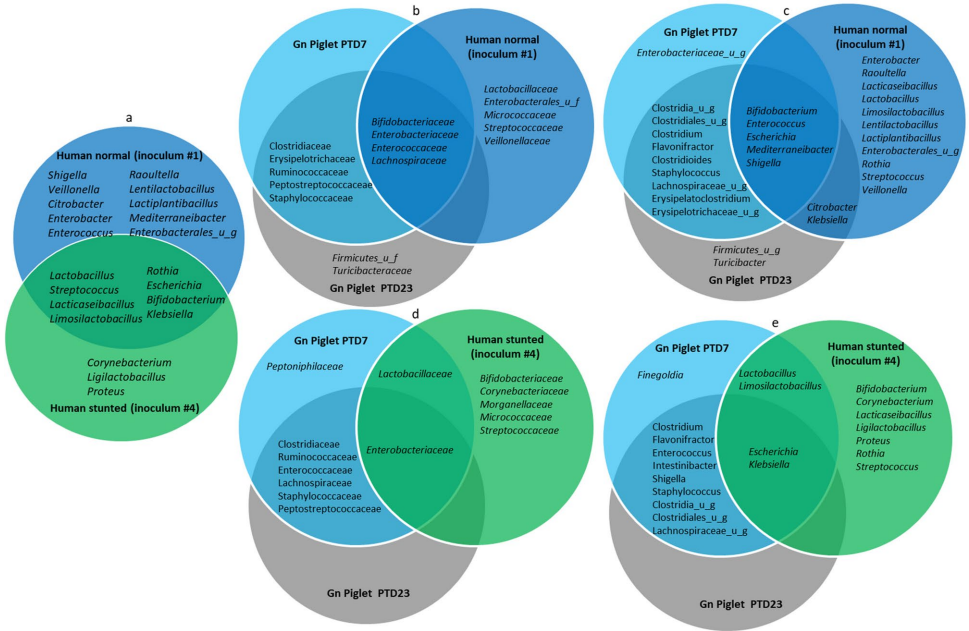
通过Shannon和Simpson指数分析发现,虽然两组幼儿的α多样性无显著差异,但无菌猪模型成功放大了健康与发育迟缓菌群的差异——移植健康菌群的猪表现出更高的物种多样性。β多样性分析显示两组幼儿菌群结构显著不同,且这种差异在猪模型中得以保持。
在门水平上,健康幼儿粪便以放线菌门(Actinobacteria,53-98%)为主,而发育迟缓幼儿则以变形菌门(Proteobacteria,44-81%)占优。这种组成差异在猪模型中重现:移植健康菌群的猪肠道以厚壁菌门(Firmicutes)为主,而移植发育迟缓菌群的猪初期以变形菌门为主,后期转为厚壁菌门优势。
功能特征分析
宏基因组功能分析揭示了关键代谢差异:发育迟缓菌群富含碳水化合物活性酶(CAZymes)中的糖基转移酶(GTs),参与碳水化合物合成;而健康菌群则以糖苷水解酶(GHs)为主,负责碳水化合物降解。代谢通路分析显示,发育迟缓菌群的分解代谢(如蛋白质/氨基酸、碳水化合物和脂肪分解)通路增强,而健康菌群的合成代谢通路更为活跃。
毒力因子与抗菌素耐药性
出乎意料的是,健康幼儿菌群中检测到更多毒力相关基因(37 vs 20),但发育迟缓幼儿携带更多抗菌素耐药性(AMR)基因(15 vs 8),可能与抗生素使用史有关。在猪模型中,这些AMR基因的传递效率存在组间差异,健康菌群相关AMR基因更易在猪体内定植。
研究结论与展望
该研究首次建立了发育迟缓相关肠道菌群的无菌猪模型,证明其组成和功能特征可在动物体内稳定传递。发现发育迟缓幼儿肠道菌群呈现"分解代谢优势"模式,可能加剧宿主的营养剥夺;而健康菌群的"合成代谢优势"则支持宿主生长。研究为微生物组诊断提供了潜在标志物(如变形菌门/放线菌门比值、GTs/GHs比例),并为开发菌群定向营养干预策略奠定了基础。
未来研究可扩大样本量,结合代谢组学和宿主生理指标,深入解析特定菌株(如长双歧杆菌Bifidobacterium longum)在营养代谢中的作用。该成果发表在《Gut Pathogens》,为理解营养不良的微生物机制和开发精准干预措施提供了重要理论依据。
 生物通微信公众号
生物通微信公众号
知名企业招聘