
-

生物通官微
陪你抓住生命科技
跳动的脉搏
老年血清诱导同基因共培养微静脉模型血管功能变化的机制研究
【字体: 大 中 小 】 时间:2025年06月27日 来源:Stem Cell Reports 5.9
编辑推荐:
本研究通过构建同基因诱导内皮细胞(iECs)和周细胞(iPCs)共培养的微静脉模型,揭示了老年男性血清灌注4天后导致血管旁细胞屏障完整性丧失、低密度脂蛋白(LDL)转运异常等衰老相关血管功能障碍。研究人员发现老年血清特异性上调ACVRL1/ALK1受体介导LDL内吞,并通过改变基底膜成分和细胞周期调控加速血管衰老,为理解微血管衰老机制及开发干预策略提供了重要模型。成果发表于《Stem Cell Reports》。
血管衰老是心血管疾病和神经退行性疾病的重要诱因,其中微血管功能障碍表现为屏障渗漏和慢性炎症。尽管动物模型证实循环系统衰老因子可加速血管老化,但难以精确解析微血管段的特异性响应。约翰霍普金斯大学团队通过创新性组织工程技术,在《Stem Cell Reports》发表研究,首次建立同基因诱导多能干细胞(iPSC)来源的内皮细胞和周细胞共培养的微静脉模型,揭示了老年血清诱导血管功能衰退的分子机制。
研究采用iPSC定向分化获得诱导内皮细胞(iECs)和诱导周细胞(iPCs),通过三维模板构建直径150μm的微静脉模型模拟生理剪切力(2-4 dyne cm-2)。关键实验包括:年轻(25岁)与老年(65岁)男性血清4天灌注对比;跨内皮电阻(TEER)和荧光示踪剂(LY/2-70kDa-2MDa dextran)检测屏障功能;pHrodo Green-LDL转运分析;RNA测序解析转录组变化;免疫荧光定量occludin/胶原IV等连接蛋白表达。
Venule-like model generation and characterization
通过顺序接种iPCs和iECs构建的共培养模型显示周细胞显著增强屏障功能,70kDa右旋糖酐渗透性降低50%(p=0.017)。

Transcriptomic changes with aged serum perfusion
老年血清诱导氧化应激和DNA损伤相关通路激活,4NQO(4-硝基喹啉-1-氧化物)和H2O2响应基因显著富集。紧密连接蛋白occludin表达降低并失去连接定位,与2MDa大分子渗透性增加3倍(p=0.0027)相关。
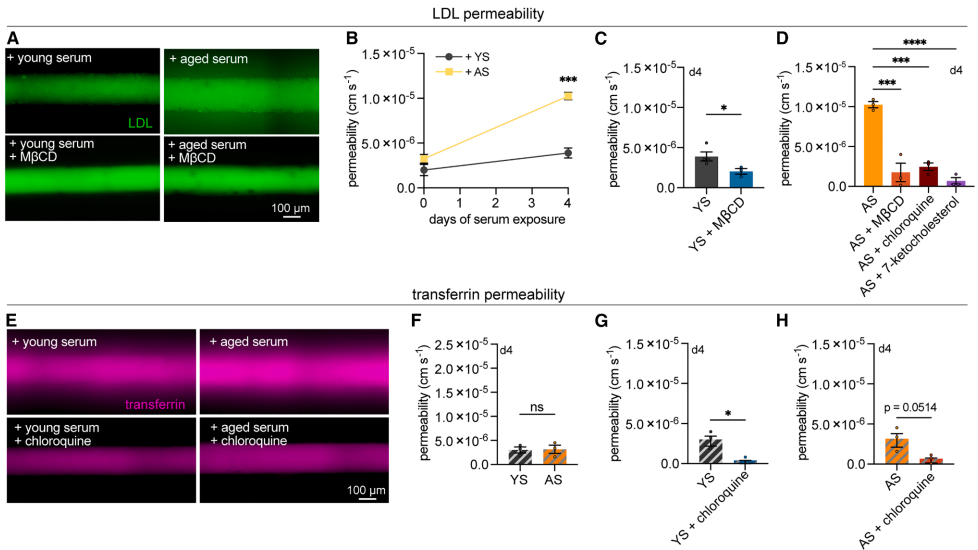
Regulation of transport and permeability
老年血清特异性上调LDL受体ACVRL1和鞘氨醇-1-磷酸受体S1PR1,而转铁蛋白转运不受影响。甲基-β-环糊精(MβCD)处理使LDL渗透性降低70%,证实胆固醇依赖的跨细胞运输机制参与。
Cell cycle shifts mediated by co-culture
共培养模型在老年血清作用下呈现独特细胞动力学:细胞丢失率(0.15% h-1)和分裂率(0.29% h-1)同步增加,Ki67/caspase-3双阳性细胞比例升高,提示周细胞通过E2F和Wnt-β连环蛋白通路调控衰老相关细胞周期紊乱。
该研究创新性地证明循环衰老因子可独立诱发微静脉段特异性功能障碍,建立了首个可解析内皮-周细胞互作的工程化模型。发现occludin定位异常和LDL转运失调等可作为血管衰老标志物,为靶向干预年龄相关血管疾病提供了新思路。特别值得注意的是,老年血清诱导的基底膜成分改变(胶原IV下调50%)和双途径内吞激活,为理解动脉粥样硬化等疾病的微血管起源提供了机制线索。该模型未来可用于筛选特异性逆转血管衰老的分子靶点。
 生物通微信公众号
生物通微信公众号
知名企业招聘