
-

生物通官微
陪你抓住生命科技
跳动的脉搏
表皮角质形成细胞在狂犬病病毒经浅表暴露感染中的作用机制研究
【字体: 大 中 小 】 时间:2025年06月28日 来源:npj Viruses
编辑推荐:
本研究针对狂犬病病毒(RABV)通过浅表伤口(如抓伤或蝙蝠咬伤)感染的机制不明问题,由荷兰伊拉斯姆斯医学中心等机构团队通过动物实验和自然感染样本分析,首次证实RABV可在临床期感染表皮角质形成细胞(keratinocytes),但未能通过离体皮肤接种或浅表暴露实验复现感染。研究揭示了RABV经皮肤感染的复杂性,为完善暴露后预防(PEP)策略提供了重要依据。论文发表于《npj Viruses》。
狂犬病作为致死率近100%的人畜共患病,每年导致至少5.9万例死亡,其中99%由犬咬伤传播。然而,约8%的病例源于浅表暴露(如抓伤或蝙蝠咬伤),其感染机制长期未明。尤其值得关注的是,蝙蝠相关病例中83%无明确咬伤史,而现有暴露后预防(PEP)中免疫球蛋白(RIG)在流行国家的覆盖率仅1-2%。这些未被充分认识的传播途径,使得理解RABV经皮肤感染的细胞机制成为公共卫生的关键科学问题。
荷兰伊拉斯姆斯医学中心Carmen W.E. Embregts团队通过三组实验系统探索了角质形成细胞在RABV感染中的作用。首先采用银毛蝙蝠狂犬病毒(SHBRV)株经肌肉(i.m.)或皮内(i.d.)接种小鼠,发现临床期动物表皮层存在RABV抗原阳性角质形成细胞(通过Keratin-14标记确认),且仅见于发病个体(4/18 i.m.和4/17 i.d.)。这些感染灶呈剂量依赖性,分布于表皮各层,但未见于非接种部位或潜伏期样本。
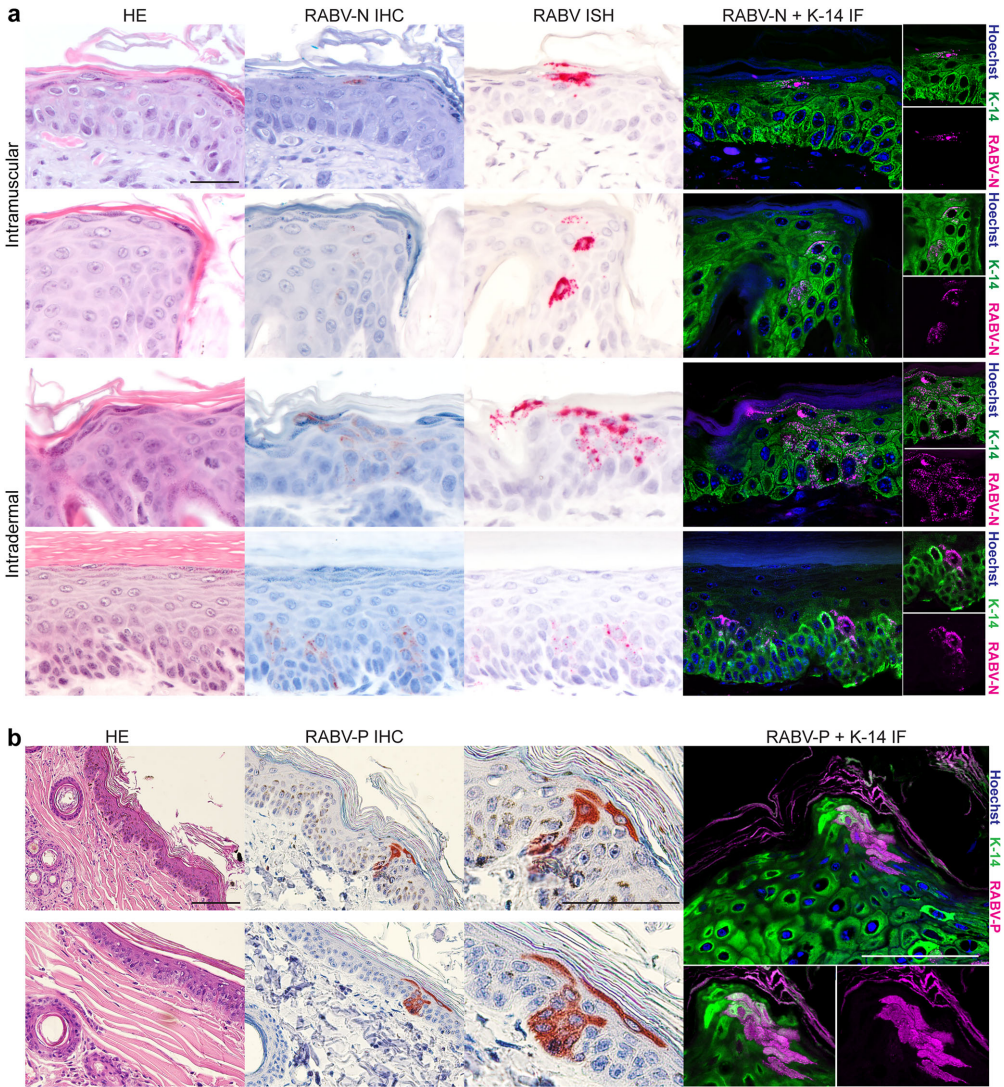
更关键的是,研究团队在南非狂犬病暴发期间采集的26只自然感染犬样本中,7只有明确咬痕的个体中有3只检出表皮角质形成细胞感染,其分布模式与小鼠实验一致。这一发现排除了实验人工性的可能,证实了自然感染中角质形成细胞感染的现实性。
然而,离体实验未能复现该现象:小鼠和犬皮肤活检经完整表皮接种、划痕或皮内注射SHBRV后,48小时内均未检测到感染细胞。体内实验进一步显示,小鼠耳部皮肤(高神经密度区域)经完整/刷擦/浅表划痕接种后,无一发展为临床狂犬病(0/18),且脑组织和接种部位均未检出病毒抗原或RNA,与肌肉接种对照组(6/6发病)形成鲜明对比。
技术方法上,研究结合了体内感染模型(C57BL/6小鼠i.m./i.d./表皮接种)、自然感染样本分析(南非犬皮肤活检)、免疫组织化学(IHC检测RABV-N/P蛋白)、免疫荧光(IF标记Keratin-14)和原位杂交(ISH靶向SHBRV糖蛋白基因),并通过Illumina MiSeq测序验证病毒株稳定性。
主要发现:
讨论部分指出,虽然角质形成细胞与表皮神经末梢存在密切接触(反射弧理论支持其潜在传播作用),但现有证据更支持其作为疾病晚期"旁观者感染"的角色。该研究首次系统评估了RABV经皮肤感染的细胞机制,对完善PEP指南(特别是浅表暴露的风险评估)具有重要价值。作者强调,尽管角质形成细胞直接参与初始感染的可能性较低,但完全排除其贡献仍需更精细的时空追踪研究。
这项发表于《npj Viruses》的工作为理解RABV多途径传播提供了关键实验证据,同时揭示了当前动物模型的局限性——未能完全模拟自然暴露条件下(如蝙蝠微小咬伤)的病毒-宿主相互作用。未来研究需结合更接近自然暴露的接种方法(如模拟蝙蝠口器穿透),以最终解答角质形成细胞是否可能成为RABV突破皮肤屏障的"特洛伊木马"。
 生物通微信公众号
生物通微信公众号
知名企业招聘