
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:NSD蛋白在抗肿瘤免疫中的作用及其蛋白降解靶向嵌合体的治疗靶向性
【字体: 大 中 小 】 时间:2025年07月01日 来源:Cellular and Molecular Life Sciences 6.2
编辑推荐:
这篇综述深入探讨了核受体结合SET结构域(NSD)家族蛋白(NSD1/2/3)通过组蛋白甲基化(如H3K36me2)调控肿瘤免疫微环境的作用机制,并系统评估了蛋白降解靶向嵌合体(PROTAC)等新型降解剂在靶向NSD蛋白治疗中的潜力。文章揭示了NSD蛋白在免疫逃逸(如CXCL9/10沉默)、抗原呈递(MHC-I下调)和免疫检查点(PD-L1)调控中的双重角色,为克服免疫治疗耐药性提供了表观遗传学干预策略。
转录失调是癌症发展的核心驱动力,涉及转录因子异常、表观遗传修饰(如组蛋白甲基化)和免疫逃逸机制的协同作用。核受体结合SET结构域(NSD)家族蛋白(NSD1/2/3)作为组蛋白甲基转移酶,通过催化H3K36单/双甲基化(H3K36me1/2)调控基因表达,并在DNA损伤修复、细胞周期等非转录过程中发挥关键作用。近年来,NSD蛋白的过表达、突变或染色体易位(如t(4;14)易位)被证实与血液肿瘤和实体瘤的发生发展密切相关,同时其通过表观遗传重编程调控抗肿瘤免疫的机制逐渐成为研究热点。
NSD家族包含三个成员:
这些蛋白通过SET结构域、锌指模块和核定位信号发挥作用,且能甲基化非组蛋白底物(如CD147-K148me2),拓展了其功能多样性。
NSD1突变在头颈鳞癌(HNSCC)和肺鳞癌(LUSC)中呈现矛盾性免疫特征:
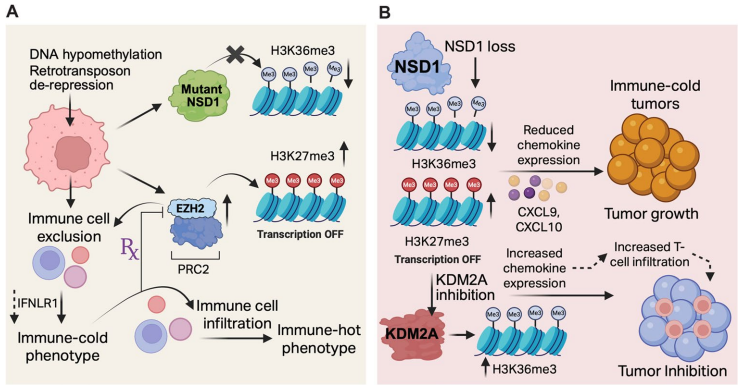
NSD2通过多种机制影响肿瘤免疫:

NSD3扩增与LUSC和乳腺癌的免疫冷表型相关:
传统小分子抑制剂(如SET域抑制剂)因无法阻断非催化功能而疗效有限。蛋白降解靶向嵌合体(PROTAC)展现出独特优势:
NSD蛋白通过表观遗传重编程和非经典底物甲基化动态调控肿瘤免疫微环境,其功能具有组织特异性。靶向降解策略(如PROTAC)通过消除NSD的全功能域,为克服免疫治疗耐药提供了新思路。未来需进一步明确NSD在不同癌种中的免疫调控图谱,并探索其与免疫检查点抑制剂、表观遗传药物(如EZH2抑制剂)的联合治疗潜力。
 生物通微信公众号
生物通微信公众号
知名企业招聘