
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:CENP-A与马科动物着丝粒的进化研究
【字体: 大 中 小 】 时间:2025年07月01日 来源:Chromosome Research 2.4
编辑推荐:
这篇综述深入探讨了马科动物(Equus)着丝粒的独特进化机制,揭示了不依赖卫星DNA的着丝粒(CENP-A binding domains)通过表观遗传调控形成可遗传的"位置等位基因"(epialleles)。研究发现CENP-B蛋白与着丝粒核心功能解耦的新现象,并阐明着丝粒重定位(centromere repositioning)和罗伯逊融合(Robertsonian fusion)是马科动物核型快速进化的两大驱动力,为哺乳动物着丝粒生物学提供了全新视角。
马科动物着丝粒的进化奇迹
在生命演化的长河中,马科动物(Equus)的基因组展现出了令人惊叹的可塑性。这个包含家马(E. caballus)、普氏野马(E. przewalskii)、驴(E. asinus)和多种斑马物种的类群,其核型进化速率高达其他哺乳动物的80倍。这种惊人的进化活力背后,隐藏着着丝粒生物学最迷人的奥秘。
着丝粒功能的表观遗传革命
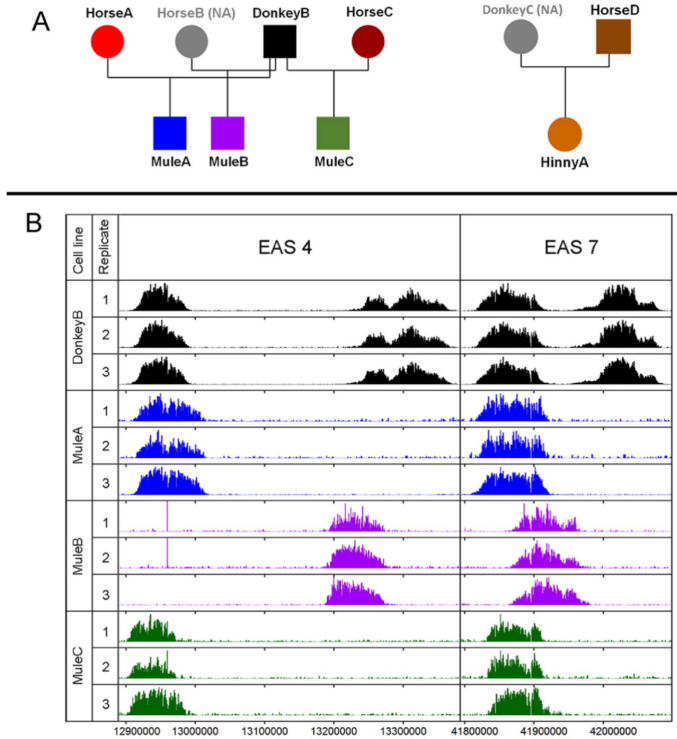
传统认知中,哺乳动物着丝粒总是与长达兆碱基的卫星DNA(satellite DNA)阵列相伴。然而马科动物打破了这一常规,其多达一半的染色体拥有完全不含卫星DNA的着丝粒。这些"裸奔"的着丝粒核心由组蛋白变体CENP-A标记,其结合域的位置在不同个体间存在约600kb的滑动窗口,形成可稳定遗传的"位置等位基因"(epialleles)。

通过分析马-驴杂交后代发现,这些表观等位基因遵循孟德尔遗传规律,但在代际传递过程中可能发生50-80kb的位置偏移。有趣的是,这种滑动仅发生在减数分裂过程中,体细胞分裂时着丝粒位置保持稳定。更令人惊讶的是,无论是否含有卫星DNA,这些着丝粒在染色体分离精确度和减数分裂重组抑制(centromere effect)方面表现完全一致,证明着丝粒功能本质上是表观遗传的。
CENP-B的"离家出走"
在人类和小鼠中,CENP-B蛋白总是与着丝粒核心形影不离。但马科动物展现了颠覆性的画面:CENP-B与其结合位点(CENP-B box)从着丝粒核心"离家出走"。免疫荧光显示,家马仅1/3染色体着丝粒有CENP-B信号,驴和草原斑马(E. burchelli)则完全检测不到,而细纹斑马(E. grevyi)的CENP-B主要分布在染色体末端。
分子水平分析发现,马科动物的主要着丝粒卫星(如37cen)竟然不含CENP-B box,而含有该元件的CENPB-sat卫星却远离着丝粒核心。这种CENP-A/CENP-B解耦现象挑战了着丝粒稳定性的传统认知——即使完全缺失CENP-B,着丝粒仍能保持完美的染色体分离功能。
着丝粒诞生的双路径模型
马科动物卫星DNA缺失着丝粒的起源揭示了两条进化路径:
路径A:着丝粒重定位(centromere repositioning)
祖先着丝粒失活后,新着丝粒(neocentromere)在单拷贝序列上"白手起家",而祖先卫星DNA逐渐退化。家马11号染色体就是典型代表,其着丝粒完全不含重复序列,却稳定存在所有个体中。
路径B:罗伯逊融合(Robertsonian fusion)
两条祖先染色体的近着丝粒区域融合后,新着丝粒在融合接点附近"另起炉灶"。斑马的多条融合染色体显示,即使融合区含有祖先卫星DNA,CENP-A结合域也会"逃逸"到邻近单拷贝区域。
这些发现改写了着丝粒成熟理论:卫星DNA并非着丝粒形成的必要条件,而是进化后期的"装饰品"。马科动物独特的基因组环境——高密度的转座元件(LINE-1)和AT富集区域,可能为新着丝粒形成提供了理想的表观遗传"温床"。
进化启示录
马科动物着丝粒研究为理解哺乳动物基因组进化提供了关键启示:
这些发现不仅丰富了着丝粒生物学理论,也为理解染色体疾病和物种形成机制提供了新视角。正如研究者所言:"马科动物就像着丝粒进化的活体实验室,让我们得以窥见哺乳动物基因组最深邃的奥秘。"
 生物通微信公众号
生物通微信公众号
知名企业招聘