
-

生物通官微
陪你抓住生命科技
跳动的脉搏
人工智能与生物分子预测软件时代下的神经精神药理学革命
【字体: 大 中 小 】 时间:2025年07月01日 来源:NPP—Digital Psychiatry and Neuroscience
编辑推荐:
本文探讨了人工智能(AI)在神经精神疾病治疗领域的突破性应用。研究人员通过AlphaFold等AI驱动的蛋白质结构预测工具,解决了传统药物开发中耗时的化学合成和体内测试瓶颈,成功加速了TAAR1受体配体的发现,为精神分裂症和代谢紊乱等疾病提供了新型治疗靶点。该研究标志着AI在精准医疗中的关键作用,为神经精神药理学研究开辟了新范式。
神经精神药理学研究的范式转变
在探索脑部疾病治疗方法的漫长征程中,科学家们长期依赖试错法进行药物开发。从1865年Crum-Brown提出结构-活性关系(SAR)理论,到现代定量结构-活性关系(QSAR)的机器学习模型,药物发现始终面临着耗时耗力的实验验证瓶颈。尤其对于G蛋白偶联受体(GPCR)这类重要靶点,传统方法需要数年时间才能解析其三维结构并筛选有效化合物。
这种困境在神经精神疾病领域尤为突出。以精神分裂症为例,现有抗精神病药通过阻断多巴胺D2受体发挥作用,但常导致迟发性运动障碍等严重副作用。而痕量胺相关受体1(TAAR1)作为调控多巴胺、5-羟色胺系统的关键靶点,虽具有治疗潜力,却因结构解析困难使药物开发举步维艰。
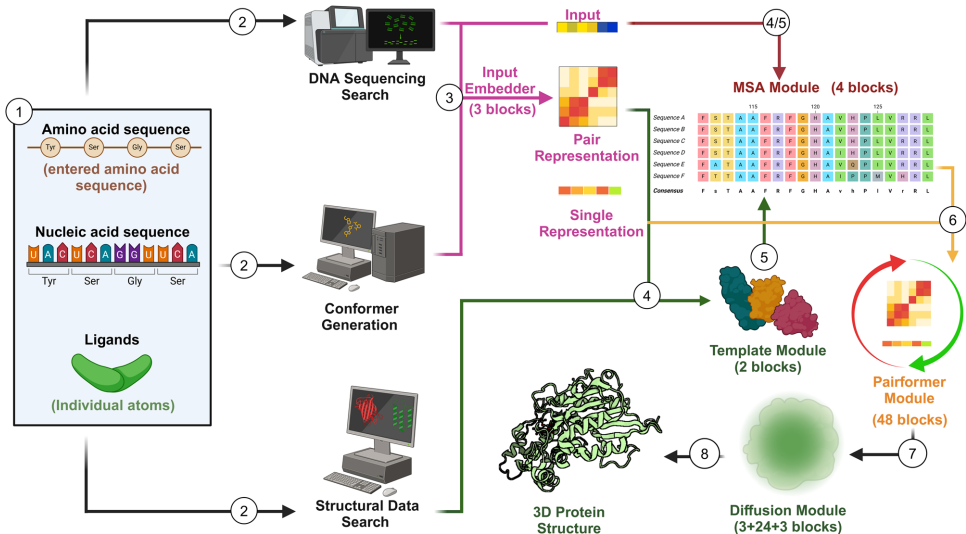
华盛顿大学的研究团队在《NPP—Digital Psychiatry and Neuroscience》发表的研究中,创新性地将AlphaFold3生物分子预测软件应用于TAAR1配体筛选。该技术通过多重序列比对(MSA)和扩散网络算法,实现了原子级精度的蛋白质结构预测,成功从1600万化合物库中筛选出高选择性TAAR1激动剂compound 65,动物实验证实其能改善感觉运动门控且无运动副作用。这项研究将传统10-15年的药物开发周期缩短近3年,验证了AI在神经精神药理学中的变革潜力。
关键技术方法
研究采用AlphaFold3预测TAAR1三维结构,结合ZINC数据库进行虚拟筛选。通过分子对接评估1600万化合物的结合特性,筛选出30个候选分子进行体外验证。最终化合物在小鼠模型中进行行为学测试(体感门控和体温调节),并通过TAAR1基因敲除动物验证靶点特异性。
当前生物分子预测软件的应用
AlphaFold3展现出超越传统同源建模的显著优势:在TAAR1案例中实现60%的命中率,较同源模型(22%)提升近3倍。其扩散网络能模拟分子间作用力,通过迭代优化氨基酸空间位置,在2020年CASP竞赛中达到与实验结构相当的全局距离测试(GDT)分数。
生物分子预测软件的局限性
尽管取得突破,AI预测仍存在关键缺陷:无法量化结合亲和力,对分子手性预测准确率低(约70%),且难以模拟共价药物结合。在测试中会出现"数字幻觉"——生成不存在于天然结构的虚假特征。对固有无序蛋白区域和非特异性相互作用的预测也需人工校正。
讨论与展望
该研究证实AI可显著加速神经精神药物发现早期阶段,但后续仍需湿实验验证。未来需整合药物化学与物理原理改进算法,同时加强生物医学研究者与AI开发者的跨学科合作。随着AlphaFold等工具在GPCR研究中的应用拓展,神经精神药理学正迈向"数字优先"的新纪元,为精神分裂症、物质使用障碍等复杂疾病提供更精准的治疗方案。

这项由Ruben A. Garcia-Reyes团队开展的工作,不仅为TAAR1靶向治疗奠定基础,更建立了AI驱动神经精神药物开发的标准化框架。正如作者强调,在保持技术创新的同时,必须建立合理的应用边界,确保AI作为辅助工具而非替代人类决策,方能真正实现神经精神疾病治疗的精准化突破。
 生物通微信公众号
生物通微信公众号
知名企业招聘