
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:干细胞信号通路的药理学调控及其治疗应用
【字体: 大 中 小 】 时间:2025年07月02日 来源:Stem Cell Research & Therapy 7.1
编辑推荐:
这篇综述系统阐述了干细胞治疗中关键信号通路(如Hedgehog、TGF-β、Wnt、Notch等)的药理学调控策略,揭示了通过小分子抑制剂、单克隆抗体(mAbs)和基因编辑技术精准干预干细胞命运(如自我更新、分化)的潜力,为癌症、退行性疾病和组织修复提供了创新治疗思路。文章还探讨了临床转化面临的挑战(如免疫排斥、致瘤性)及多学科协同解决方案。
干细胞凭借自我更新和多向分化能力,成为修复组织、治疗癌症和退行性疾病的核心工具。胚胎干细胞(ESCs)具有全能性,而成人干细胞(ASCs)如间充质干细胞(MSCs)具有多能性,可分化为中胚层组织(如骨、软骨)。MSCs的免疫调节特性使其在治疗自身免疫疾病中备受关注。

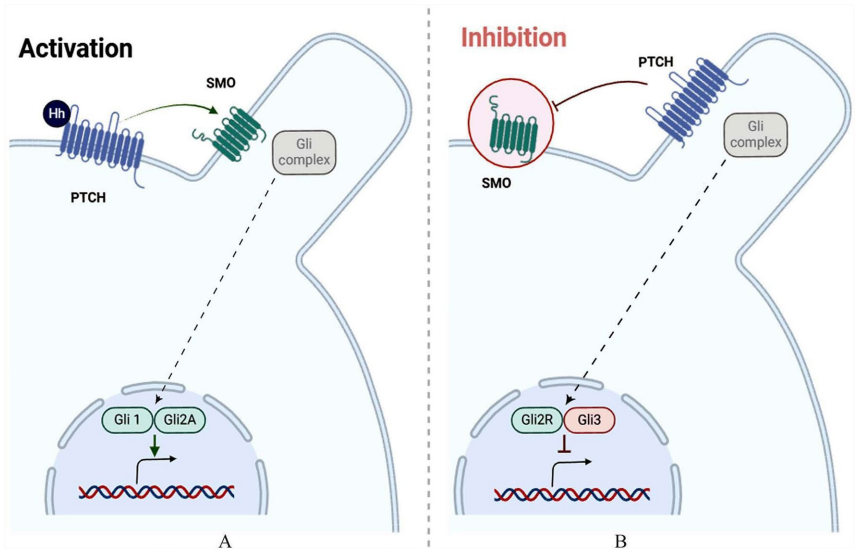
TGF-β通路通过SMAD1/5/8和SMAD2/3分支调控干细胞稳态,其双重角色(抑制肿瘤或促进转移)使靶向药物如Galunisertib(TβRI抑制剂)需谨慎设计。Notch通路通过γ-分泌酶介导的NICD释放维持干细胞库,抑制剂DAPT可克服化疗耐药。Hedgehog通路中SMO抑制剂Vismodegib已获批治疗基底细胞癌,通过阻断Gli转录因子活性抑制肿瘤干细胞(CSCs)自我更新。
Wnt通路的β-catenin依赖与非依赖分支分别调控细胞命运和运动,小分子CHIR99021通过抑制GSK-3β促进骨再生。FGF通路通过PI3K-AKT维持干细胞多能性,而抑制剂AZD4547靶向FGFR1-3突变癌症。Hippo通路的效应分子YAP/TAZ与TEAD结合驱动干细胞增殖,其抑制剂Verteporfin可阻断肿瘤生长。
靶向药物需平衡疗效与安全性:如TGF-β抑制剂可能加剧纤维化,而Notch抑制可能影响组织再生。联合疗法(如免疫检查点抑制剂)和纳米递送系统正成为突破方向。临床转化需解决干细胞致瘤性、免疫排斥及异质性响应问题。
结合CRISPR基因编辑、类器官工程和个性化医疗,干细胞疗法将迈向精准化。目前全球116项hPSC临床试验中,视网膜和中枢神经系统疾病进展显著,但大规模应用仍需优化制造工艺和监管框架。
(注:全文严格依据原文内容缩编,未添加非文献支持结论)
 生物通微信公众号
生物通微信公众号
知名企业招聘