
-

生物通官微
陪你抓住生命科技
跳动的脉搏
基础代谢率调控肝细胞癌发展的分子机制:从细胞尺寸到mTOR信号通路的探索
【字体: 大 中 小 】 时间:2025年07月02日 来源:BMC Cancer 3.4
编辑推荐:
本研究针对肝细胞癌(HCC)发展中的代谢调控机制,通过基因选育的高/低基础代谢率(BMR)小鼠模型,结合DEN诱导的肝癌发生实验,揭示了高BMR通过PI3K/mTOR和β-catenin/c-myc通路促进肿瘤进展的机制。研究发现高BMR个体肝细胞尺寸增大、蛋白合成增强,伴随p53/APC抑制和CTNNB1过表达,为代谢干预抗癌策略提供了新靶点。
肝细胞癌作为全球第四大癌症死因,其发生发展与代谢异常密切相关。有趣的是,流行病学数据显示基础代谢率(BMR)升高与多种癌症风险正相关,但这一现象背后的生物学机制始终未明。肝脏作为人体代谢中枢,其质量占全身BMR的20%,使得研究者猜测:是否代谢率差异会通过改变肝细胞特性而影响癌变进程?这一科学问题因缺乏合适的动物模型而长期悬置。
波兰比亚韦斯托克大学的研究团队利用其独特的实验资源——经过61代选育的高/低BMR小鼠品系(代谢率差异达60%),首次建立了代谢率与肝癌发展的直接因果关系。这些小鼠不仅BMR差异显著,其肝细胞尺寸和器官质量也存在根本性差异,为破解代谢-癌症关联提供了理想模型。通过DEN(二乙基亚硝胺)化学诱导肝癌实验,结合多组学分析,研究发现高BMR小鼠肝癌进展更快,35周即出现典型HCC病理特征,而低BMR组仅表现癌前病变。这一突破性成果发表于《BMC Cancer》,揭示了代谢率通过细胞尺寸调控和信号通路重编程影响肿瘤发生的新机制。
研究采用三大关键技术:1) 开放回路呼吸测量系统精确测定小鼠BMR;2) DEN/PB(苯巴比妥)二阶段肝癌诱导模型模拟人类HCC进展;3) qPCR和ELISA检测mTOR、β-catenin等7个关键基因/蛋白的表达动态。
细胞尺寸与代谢负荷
高BMR小鼠肝细胞面积增加30%,伴随总蛋白浓度升高(p<0.001),证实代谢率差异源于细胞架构改变。DEN处理后,HBMR组肝脏质量增幅达低BMR组的2倍,显示代谢活跃细胞对致癌物更敏感。
致癌信号通路激活

细胞周期调控失衡
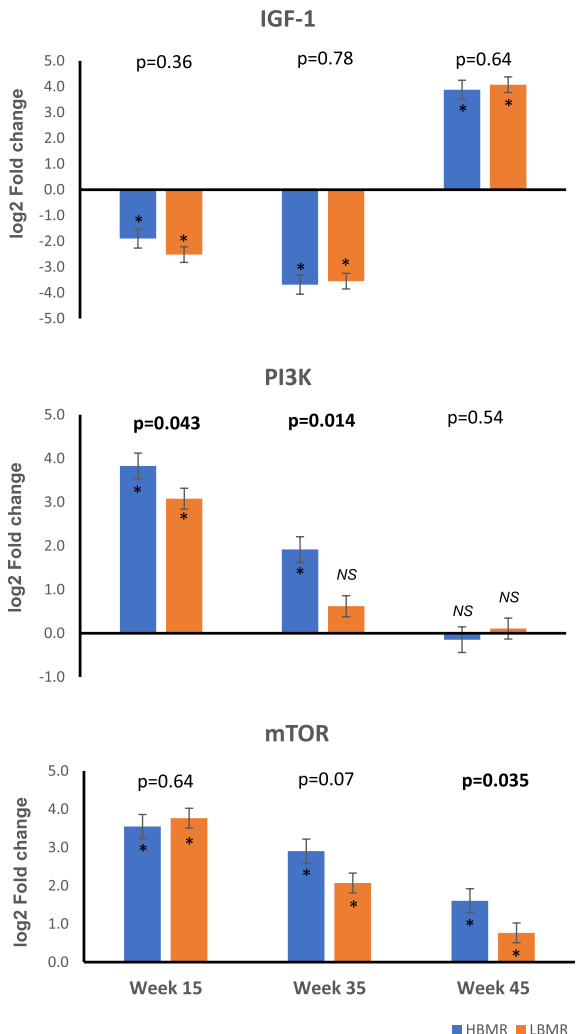
该研究首次证实:1) 遗传性高BMR通过PI3K/mTOR和β-catenin双重通路加速肝癌发展;2) 细胞尺寸增大导致的代谢压力是癌变的关键推手;3) 低BMR状态对肿瘤进展具有保护作用。这一发现为"代谢干预"抗癌策略提供了理论依据——通过调节mTOR活性或β-catenin信号可能抵消高代谢个体的患癌风险。更深远的意义在于,现代人类BMR的持续下降(过去百年降低约5%)可能是一种对抗癌症的进化适应,这为公共卫生领域的癌症预防提供了全新视角。
 生物通微信公众号
生物通微信公众号
知名企业招聘