
-

生物通官微
陪你抓住生命科技
跳动的脉搏
机械应力增强间充质干细胞外泌体分泌及其在角膜修复中的再生作用
【字体: 大 中 小 】 时间:2025年07月02日 来源:Journal of Nanobiotechnology 10.6
编辑推荐:
本研究针对间充质干细胞(MSCs)来源的小细胞外囊泡(sEVs)产量低、功能单一的问题,开发了一种可编程旋转平台(PRP),通过离心力施加法向应力刺激脐带MSCs,使sEV分泌量提升4倍且显著增强其促进角膜上皮迁移和抑制炎症的再生能力。该研究为sEVs的规模化生产和临床转化提供了创新技术方案。
在再生医学领域,间充质干细胞(MSCs)来源的小细胞外囊泡(sEVs)因其天然生物相容性和跨越生物屏障的能力,被视为极具潜力的治疗工具。然而,sEVs从实验室走向临床面临两大瓶颈:一是静息状态下细胞分泌的sEVs数量有限,二是天然sEVs携带的生物活性分子往往功能单一。传统化学诱导方法虽能提高产量,但可能引入外源污染物;现有物理刺激技术如流体剪切力、拉伸应力等又存在设备复杂、难以标准化的问题。如何建立一种简便高效的sEVs生产系统,同时增强其治疗效能,成为亟待解决的科学难题。
针对这一挑战,温州医科大学眼视光学院国家眼视光工程研究中心联合武汉大学人民医院等机构的研究团队,在《Journal of Nanobiotechnology》发表创新性研究成果。研究人员设计出可编程旋转平台(PRP),通过精确控制离心力对脐带MSCs施加持续法向应力,实现sEVs的高效生产与功能强化。该系统仅需将培养瓶垂直固定于旋转平台,在15xg离心力下培养12小时,即可使sEVs产量提升4倍,且维持细胞存活率>95%。更重要的是,这些机械应力诱导的sEVs展现出卓越的角膜修复能力——在小鼠模型中36小时内实现近乎完全的上皮再生,同时显著降低炎症因子TNF-α和IL-1β表达。
关键技术方法
研究采用多学科交叉技术:(1)PRP系统整合流体力学模拟(COMSOL软件)优化力学参数;(2)超速离心结合纳米颗粒追踪分析(NTA)分离表征sEVs;(3)转录组与蛋白质组学解析机械应力响应机制;(4)角膜划痕实验(scratch assay)和EdU增殖检测评估再生效果;(5)小鼠角膜上皮损伤模型验证治疗效能。所有实验均使用3例供体来源的脐带MSCs(P6代以内)。
研究结果
Culture and dynamic stress analysis of MSC on a programmable rotating platform
通过流体力学模拟证实,恒定转速下细胞主要承受流体静压力而非剪切力。实验发现离心侧(OS)细胞存活率显著高于向心侧(IS)(>95% vs <90%),确立OS为最佳培养方位。

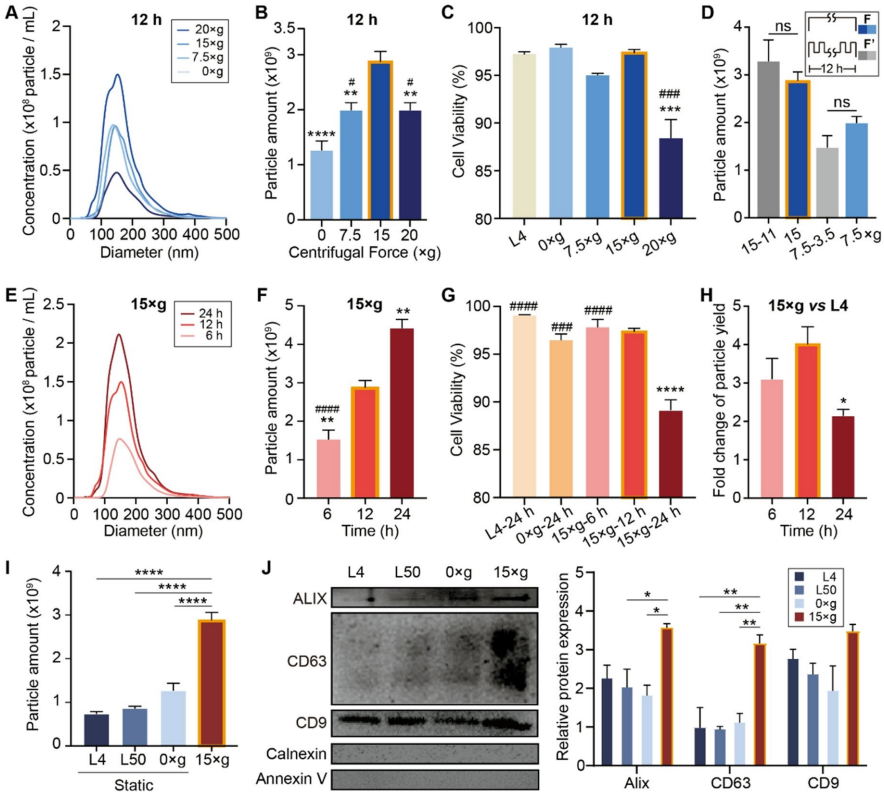
Preparation of MSC-derived sEVs based on PRP
15xg恒定离心力12小时为最优参数,sEVs产量达静态培养4倍(粒径稳定在40-200nm),且Western blot验证标志蛋白Alix/CD9高表达。
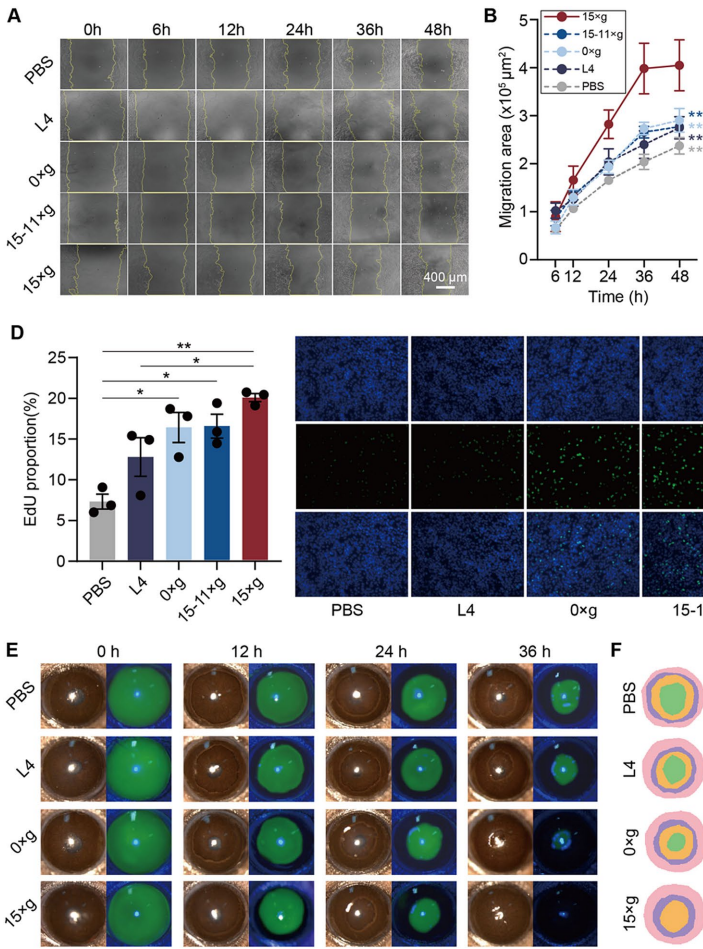
PRP-based MSC-sEVs showing enhanced biological activity in corneal wound healing
PRP-sEVs处理组24小时即促进角膜上皮细胞迁移面积增加2.3倍,小鼠模型中36小时上皮愈合率达100%,显著优于静态培养sEVs组(65%)。
PRP culture modulates cellular transcription and behavior
转录组分析揭示15xg组显著上调细胞骨架(β-catenin)和囊泡运输(ESCRT复合体)相关基因,下调炎症通路(MAPK/PI3K)。β-连环蛋白(β-catenin)表达增加2.1倍证实机械应力增强细胞粘附。
Remodeling of sEV cargo via PRP stimulation
蛋白质组学发现PRP-sEVs富含补体因子I(CFI)和丝氨酸蛋白酶抑制剂(SERPINF1),这些蛋白与角膜神经保护密切相关,解释其双重修复/抗炎功能。

结论与意义
该研究开创性地通过机械应力调控细胞微环境,实现sEVs产量与功能的双重突破。其科学价值体现在三方面:(1)PRP系统为sEVs规模化生产提供标准化方案,设备成本仅为传统生物反应器的1/10;(2)首次阐明法向应力通过激活ESCRT复合体通路促进sEVs生物发生;(3)发现机械应力诱导的sEVs具有独特"再生-抗炎"协同效应,为角膜疾病乃至视网膜退行性病变提供新治疗策略。未来可通过优化力学参数适配不同细胞类型,推动sEV疗法在再生医学中的广泛应用。
 生物通微信公众号
生物通微信公众号
知名企业招聘