
-

生物通官微
陪你抓住生命科技
跳动的脉搏
基于2.5D深度学习放射组学与临床数据融合预测肺腺癌隐匿性淋巴结转移的创新模型研究
【字体: 大 中 小 】 时间:2025年07月02日 来源:BMC Medical Imaging 2.9
编辑推荐:
本研究针对肺腺癌(adenocarcinoma)隐匿性淋巴结转移(OLNM)临床诊断难题,创新性整合2.5D深度学习、多示例学习(MIL)框架与放射组学特征,构建多模态预测模型。研究人员通过1099例多中心CT影像数据,开发出AUC达0.898的联合预测系统,为精准手术方案制定提供AI决策支持,相关成果发表于《BMC Medical Imaging》。
在肺癌诊疗领域,肺腺癌作为非小细胞肺癌(NSCLC)的主要亚型,其隐匿性淋巴结转移(OLNM)的检测始终是临床痛点。常规CT和PET/CT对纵隔淋巴结转移的阳性预测值欠佳,而超声引导穿刺又存在技术门槛高、取样局限等问题。更棘手的是,10-20%的临床T1期患者存在OLNM,但过度淋巴结清扫可能增加手术风险,精准预测成为个性化治疗的关键突破口。
广西医科大学肿瘤医院医学影像中心联合多家医疗机构,创新性地提出"2.5D+多模态"融合策略。这项发表在《BMC Medical Imaging》的研究,通过1099例多中心数据,首次将2.5D深度学习与多示例学习(MIL)框架相结合,构建了性能超越传统方法的预测系统。
研究采用三大关键技术:1)从增强CT提取±1/±2/±4切面构建2.5D数据集;2)应用DenseNet121和ResNet101等模型进行特征提取,通过PLH和BoW方法实现多示例特征聚合;3)整合18个放射组学特征与7个临床独立预测因子(如年龄、结节密度等)构建联合模型。所有数据均来自广西医科大学肿瘤医院和右江民族医学院附属医院2016-2023年的临床病例。
【研究方法】
研究团队设计阶梯式分析流程:首先通过ITK-SNAP半自动标注病灶区域,采用PyRadiomics提取1834个放射组学特征,经LASSO回归筛选出18个关键特征。同步开发2.5D深度学习模型,从7个连续切片提取深度特征,通过MIL框架实现特征聚合。最终整合临床指标(如年龄、吸烟史等)构建四类预测模型。
【临床模型表现】
基于多因素分析确定的7个独立预测因子(年龄OR=0.932,微乳头亚型OR=2.847等),临床模型在训练/验证/外部测试集的AUC分别为0.903/0.866/0.785。特别值得注意的是,微乳头生长模式显示出最强的转移预测价值。
【放射组学模型突破】
从18个筛选特征中构建的放射组学模型,其wavelet_LLL_glszm_LargeAreaHighGrayLevelEmphasis等纹理特征展现出显著预测力,三组AUC达0.865/0.892/0.796。该结果验证了肿瘤异质性特征与转移潜能的内在关联。
【MIL模型创新】
采用DenseNet121的MIL框架在切片层面取得0.787 AUC,通过概率直方图(Histo_prob)和词袋(BoW)特征融合后,模型性能显著提升至0.903/0.900/0.852。Grad-CAM可视化显示模型能准确聚焦肿瘤浸润区域(图4)。

【DLRad融合模型】
深度-放射组学融合(DLRad)特征使预测性能进一步提升,三组AUC分别达0.910/0.908/0.875。这表明深度学习与人工设计特征的互补性。
【联合模型优势】
最终整合模型展现出卓越的临床价值:训练集AUC 0.940,外部验证集仍保持0.898。决策曲线分析证实,该模型在广泛阈值概率范围内具有净获益(图8)。
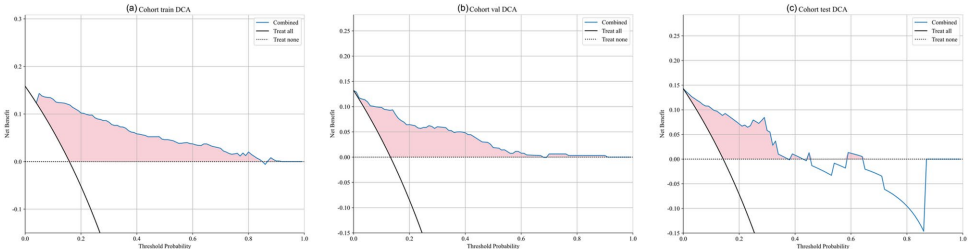
这项研究开创性地将2.5D深度学习与MIL框架应用于OLNM预测,其核心价值在于:1)突破单一切片局限,通过多层面特征聚合捕捉三维空间信息;2)首次验证MIL在肺癌影像分析的适用性;3)提供可解释的预测依据,Grad-CAM热图与临床指标形成双重验证。尽管存在回顾性研究的固有局限,但多中心验证和优异的模型稳定性,使其有望成为指导个体化淋巴结清扫的AI决策工具。未来通过前瞻性研究和PET/CT多模态融合,或将进一步推动精准肺癌外科的发展。
 生物通微信公众号
生物通微信公众号
知名企业招聘