
-

生物通官微
陪你抓住生命科技
跳动的脉搏
靶向Axl-SOCS3轴:通过调控肾小管上皮细胞炎症反应治疗急性肾损伤的新策略
【字体: 大 中 小 】 时间:2025年07月02日 来源:BMC Nephrology 2.2
编辑推荐:
本研究针对急性肾损伤(AKI)中炎症恶性循环的临床难题,揭示了Axl-SOCS3信号轴在肾小管上皮细胞(TECs)中的促炎作用机制。天津医科大学团队通过小鼠缺血再灌注(IRI)模型和人类AKI样本,发现Axl抑制剂R428可通过下调SOCS3表达抑制NF-κB通路,显著减轻肾损伤和炎症浸润。该研究为开发靶向跨细胞炎症通路的AKI治疗策略提供了重要理论依据。
急性肾损伤(AKI)作为住院患者高死亡率的危重症,其核心病理机制是肾小管上皮细胞(TECs)与免疫细胞间的炎症恶性循环。尽管NF-κB通路被公认为调控该过程的核心,但临床仍缺乏特异性干预靶点。值得注意的是,TAM受体家族成员Axl在肾脏疾病中展现出独特的"双面性"——在髓系细胞中发挥抗炎作用,却在肾微环境中促进疾病进展。这种器官特异性信号重编程现象,加上SOCS3(细胞因子信号抑制因子3)在TECs中作为NF-κB靶基因的异常高表达,构成了本研究的出发点。
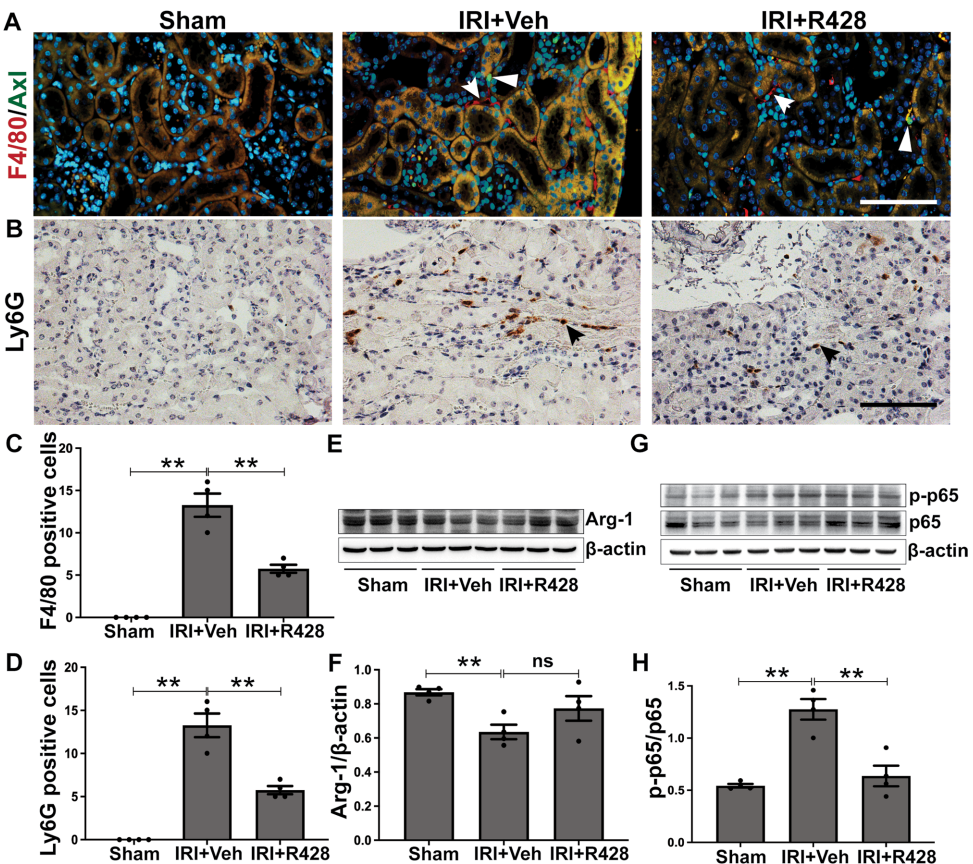
天津医科大学总医院的研究团队通过多维度实验揭示了Axl-SOCS3轴在AKI中的关键作用。在缺血再灌注(IRI)诱导的AKI小鼠模型中,发现Axl主要表达于肾间质免疫细胞,而SOCS3则特异性富集于TECs。使用高选择性Axl抑制剂R428干预后,不仅显著改善肾功能指标(血肌酐和尿素氮水平),还通过免疫荧光观察到F4/80+巨噬细胞和Ly6G+中性粒细胞浸润减少。机制上,R428通过抑制TECs中SOCS3表达,阻断NF-κB p65磷酸化,进而下调IL-1β/IL-6等促炎因子产生。这一发现得到人类AKI活检标本的验证,临床样本同样显示Axl-SOCS3轴的激活特征。
研究采用的主要技术包括:建立小鼠双侧肾缺血再灌注模型模拟临床AKI;通过免疫组化/免疫荧光进行空间蛋白定位分析;使用siRNA在HK2细胞系中敲低SOCS3研究其功能;Western blot检测NF-κB通路关键蛋白;收集3例符合KDIGO标准的AKI患者活检组织进行临床相关性验证。
研究结果部分呈现以下重要发现:
Axl和SOCS3参与IRI诱导的AKI

抑制Axl改善IRI诱导的AKI

Axl抑制减轻肾脏炎症
SOCS3敲低抑制TECs炎症反应

该研究创新性地揭示了肾脏微环境中Axl信号从"保护性"向"致病性"重编程的分子开关——通过激活TECs中SOCS3依赖性NF-κB通路,形成"免疫细胞-Axl-TECs-SOCS3-细胞因子"的正反馈循环。这一发现不仅解释了既往研究中TEC特异性SOCS3缺失为何能增加M2型巨噬细胞,更重要的是提供了精准干预这一循环的靶点。研究采用的R428(Bemcentinib)是已进入肿瘤临床试验的Axl抑制剂,其肾脏保护作用的证实为老药新用提供了可能。未来研究需明确Gas6配体在该通路中的调控作用,并探索不同AKI亚型(如脓毒症相关AKI)中该通路的异质性。这些发现为开发针对器官特异性炎症微环境的靶向疗法开辟了新途径。
 生物通微信公众号
生物通微信公众号
知名企业招聘