
-

生物通官微
陪你抓住生命科技
跳动的脉搏
整合表观基因组与转录组分析揭示ASCL1和NEUROD1在小细胞肺癌中差异调控的转录程序
【字体: 大 中 小 】 时间:2025年07月02日 来源:Oncogene 6.9
编辑推荐:
本研究通过整合表观基因组和转录组分析,揭示了ASCL1/NEUROD1双阳性小细胞肺癌(SCLC-A/N)的分子特征。研究人员发现NEUROD1通过调控miR-139-5p/PDE2A轴及其协同miRNAs网络,与ASCL1共同塑造了SCLC的分子异质性。该研究为理解SCLC亚型转化机制提供了新见解,发表在《Oncogene》杂志。
小细胞肺癌(SCLC)是一种高度侵袭性的神经内分泌肿瘤,占肺癌病例的15%左右。这种"恶魔般"的癌症以其迅猛的进展速度和极差的预后著称,5年生存率不足7%。近年来,科学家们根据关键转录因子的表达将SCLC分为四个亚型:ASCL1(achaete-scute complex homologue 1)阳性(SCLC-A)、NEUROD1(neuronal differentiation 1)阳性(SCLC-N)、POU2F3阳性和YAP1阳性亚型。其中,ASCL1和NEUROD1作为调控神经内分泌特征的关键转录因子,被认为在SCLC亚型转化中扮演重要角色。
然而,关于这两种转录因子如何协同调控基因表达网络,以及它们如何影响SCLC的分子异质性,科学界仍知之甚少。更令人困惑的是,临床观察发现约30-40%的SCLC病例同时表达ASCL1和NEUROD1(SCLC-A/N),这暗示着可能存在从SCLC-A到SCLC-N的转化过程。解开这个谜团对于理解SCLC的发病机制和开发靶向治疗策略至关重要。
日本Kobe大学等机构的研究人员开展了一项开创性研究,通过整合表观基因组和转录组分析,系统揭示了ASCL1和NEUROD1在SCLC-A/N中的差异调控机制。研究发现NEUROD1通过调控miR-139-5p及其宿主基因PDE2A,与ASCL1共同塑造了SCLC的分子特征。这项研究不仅阐明了SCLC亚型转化的分子基础,还为开发针对不同SCLC亚型的精准治疗策略提供了理论依据,相关成果发表在《Oncogene》杂志。
研究人员采用了多项前沿技术开展研究:首先通过免疫组化分析15例SCLC临床样本的ASCL1和NEUROD1表达模式;利用CUT&Tag技术在全基因组水平分析组蛋白修饰(H3K4me3、H3K27ac、H3K27me3)和转录因子结合位点;采用CRISPR/Cas9技术构建NEUROD1敲除细胞系;通过RNA-seq和small RNA-seq分析基因和miRNA表达谱;结合生物信息学方法分析公共数据库中的SCLC细胞系和临床样本数据。
研究结果部分,在"ASCL1和NEUROD1在SCLC亚群中共表达"部分,免疫组化分析显示15例SCLC样本中有7例(46.7%)同时表达ASCL1和NEUROD1。对38个SCLC细胞系的转录组分析发现,ASCL1/NEUROD1双阳性细胞(SCLC-A/N)的转录特征介于SCLC-A和SCLC-N之间,提示其可能代表亚型转化的中间状态。
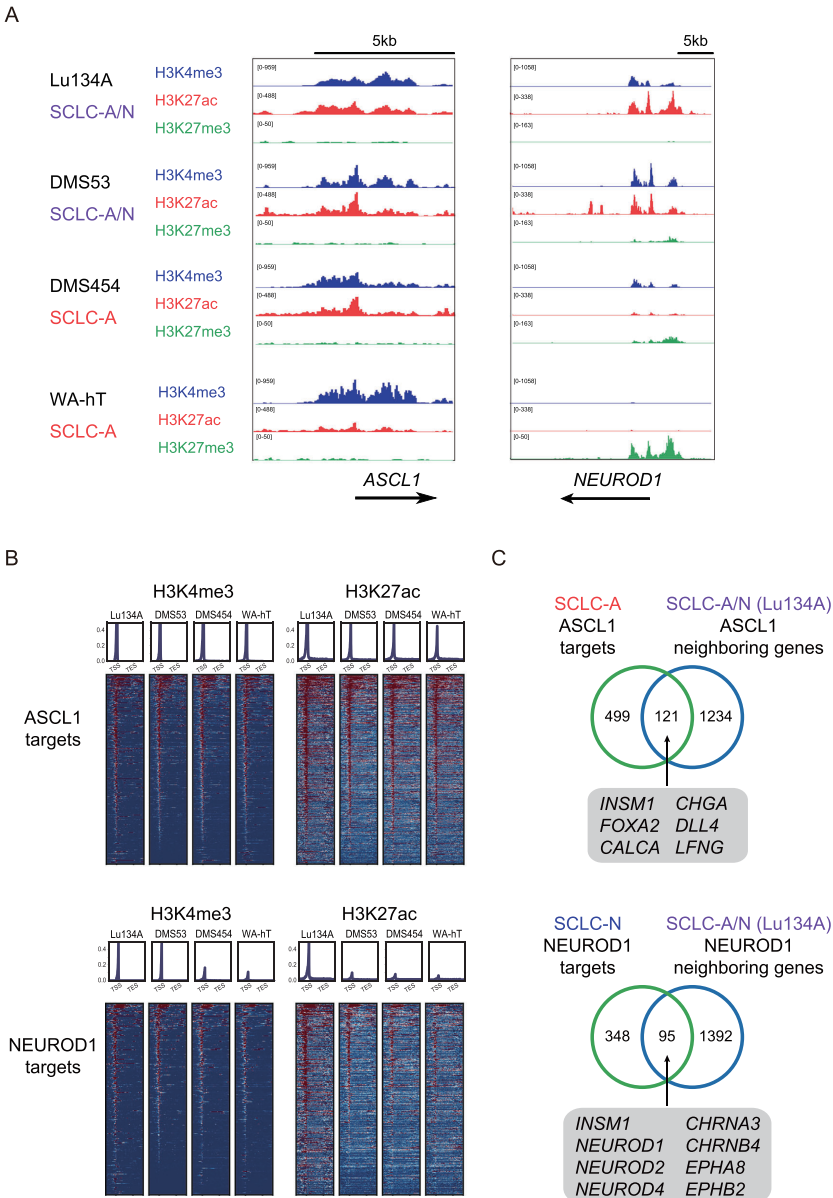
"染色质修饰和ASCL1/NEUROD1的转录调控"部分揭示,在SCLC-A/N细胞中,ASCL1和NEUROD1的靶基因启动子区域均呈现活跃的H3K4me3和H3K27ac修饰,而抑制性标记H3K27me3较少。CUT&Tag分析鉴定出1355个ASCL1靶基因和1487个NEUROD1靶基因,其中657个为共同靶基因,表明两种转录因子存在协同调控。
"NEUROD1调控SE相关基因并构成独特转录网络"部分显示,NEUROD1敲除导致235个基因下调,其中超级增强子(SE)关联基因显著富集。NEUROD1与NEUROD2、NHLH2等转录因子形成独特调控网络,与ASCL1调控网络明显不同。值得注意的是,SCLC-A/N表现出介于SCLC-A和SCLC-N之间的分子特征。
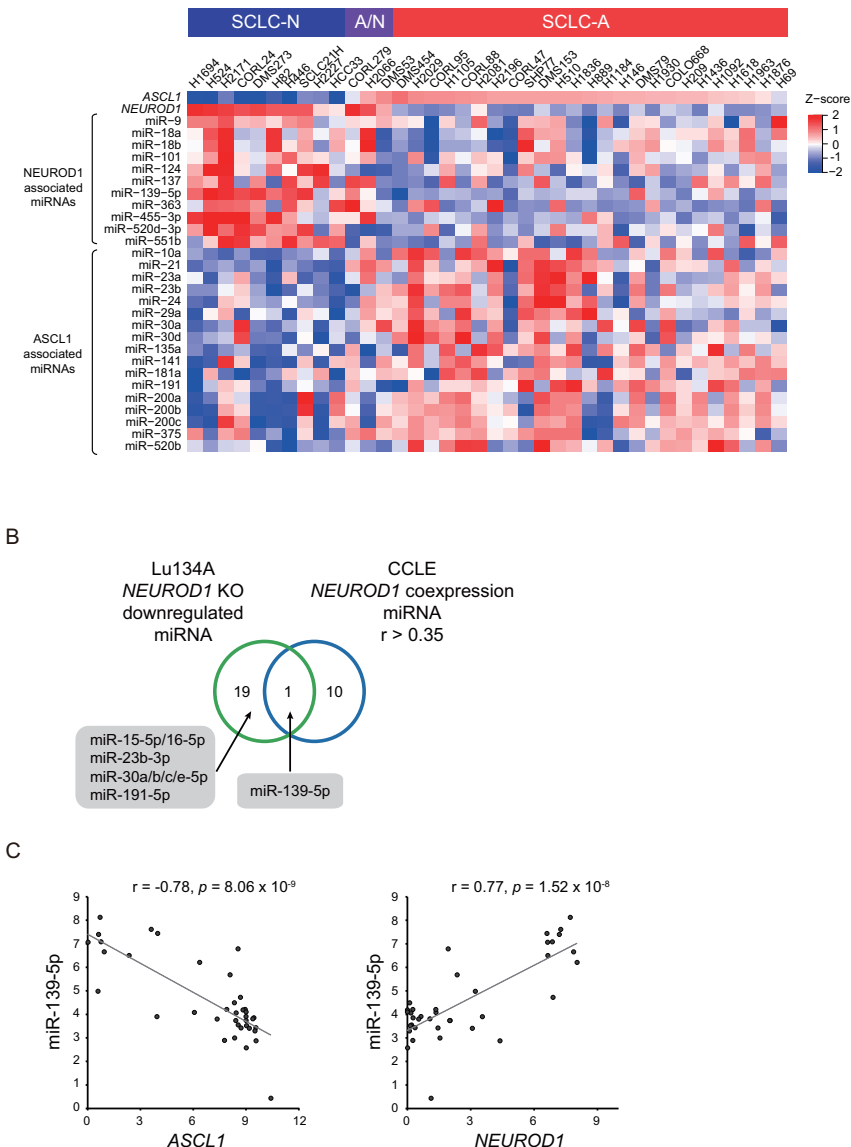
"NEUROD1调控特定miRNAs亚群"部分鉴定出11个与NEUROD1表达正相关的miRNAs,其中miR-139-5p与NEUROD1表达高度相关(r=0.77),而与ASCL1负相关(r=-0.78)。small RNA-seq分析发现NEUROD1敲除导致47个miRNAs下调,包括miR-139-5p。
"PDE2A在NEUROD1阳性SCLC中特异性表达"部分证实,NEUROD1直接结合MIR139基因上游调控区。miR-139-5p与其宿主基因PDE2A表达高度相关(r=0.88),临床样本免疫组化显示PDE2A在NEUROD1阳性病例中特异性表达。
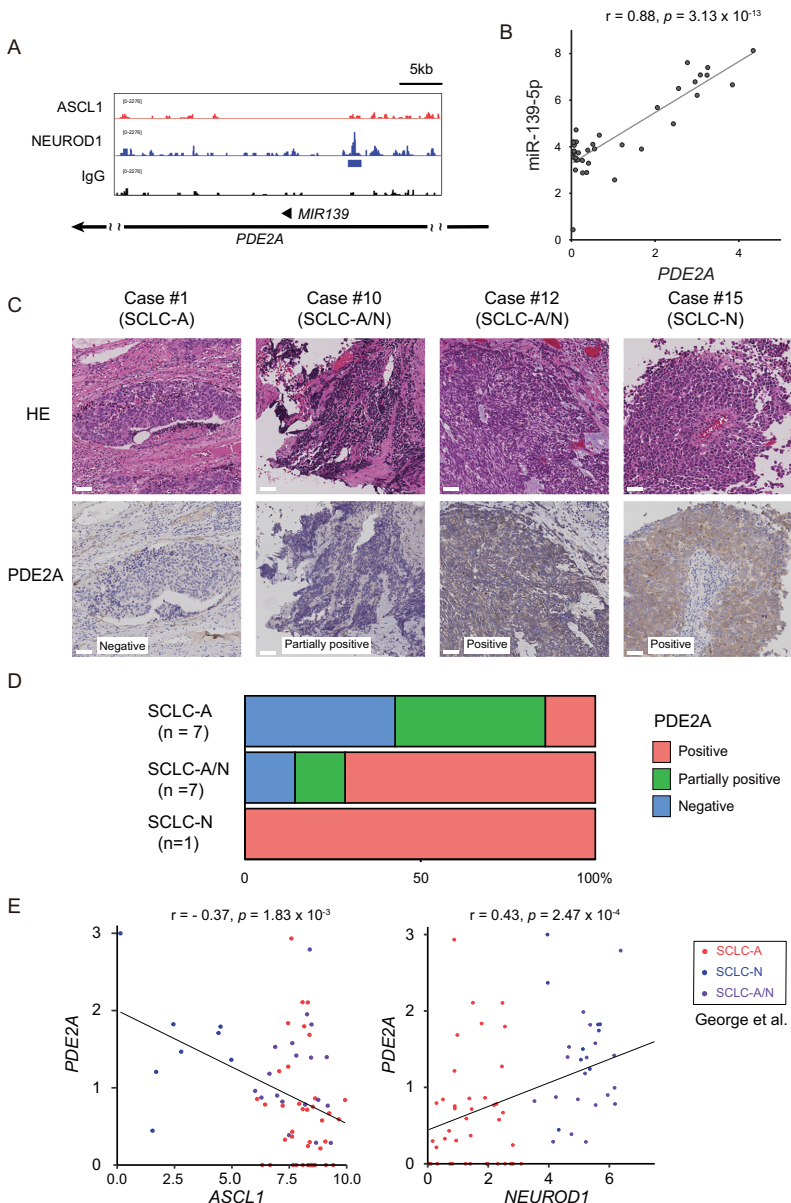
"miR-139-5p的候选靶基因及其与其他miRNAs的共调控"部分发现,miR-139-5p可能通过与miR-9、miR-18、miR-137和miR-363协同作用,调控NFIB、NOTCH1等病理相关基因。这些基因参与SCLC转移和神经内分泌分化等关键过程。
这项研究通过多组学整合分析,系统阐明了ASCL1和NEUROD1在SCLC-A/N中的差异调控机制。研究发现NEUROD1通过调控miR-139-5p/PDE2A轴及其协同miRNAs网络,与ASCL1共同塑造了SCLC的分子异质性。这些发现不仅深化了对SCLC亚型转化机制的理解,还为开发针对不同SCLC亚型的精准治疗策略提供了新思路。特别是鉴定出的miR-139-5p/PDE2A作为NEUROD1阳性SCLC的特异性标志物,具有重要的临床转化价值。该研究为SCLC的分子分型和靶向治疗开发奠定了重要理论基础。
 生物通微信公众号
生物通微信公众号
知名企业招聘