
-

生物通官微
陪你抓住生命科技
跳动的脉搏
CXCL8在宫颈癌获得性放射抵抗中的关键作用及靶向治疗潜力
【字体: 大 中 小 】 时间:2025年07月02日 来源:Scientific Reports 3.8
编辑推荐:
本研究针对宫颈癌放疗中面临的获得性放射抵抗这一临床难题,通过建立临床相关性放射抵抗细胞模型,首次揭示CXCL8(C-X-C motif chemokine ligand 8)是介导宫颈癌放射抵抗的关键分子。研究人员通过mRNA测序和生物信息学分析发现CXCL8在放射抵抗细胞中显著上调,功能实验证实CXCL8敲除可恢复放射敏感性,而外源CXCL8则诱导放射抵抗。该研究为克服宫颈癌放疗抵抗提供了新的分子靶点和治疗策略,具有重要临床转化价值。
宫颈癌作为全球女性第四大恶性肿瘤,每年导致超过34万例死亡,其中局部晚期病例的5年生存率仅为20-65%。尽管同步放化疗已成为标准治疗方案,但获得性放射抵抗(Radiotherapy Resistance, RR)仍是治疗失败的主要原因。目前临床缺乏可靠的放射抵抗细胞模型,且对肿瘤微环境(Tumor Microenvironment, TME)中关键调控分子的认识不足。特别是CXCL8这一在多种癌症中与治疗抵抗相关的趋化因子,其在宫颈癌放射抵抗中的作用尚未阐明。
郑州大学第一附属医院放射肿瘤科和妇科的研究团队在《Scientific Reports》发表的研究,通过模拟临床放疗方案建立了HeLa-RR和SiHa-RR两种获得性放射抵抗细胞株。采用mRNA测序技术鉴定出50个共同上调基因,其中CXCL8位列差异表达基因前列。通过TCGA-CESC数据集分析筛选出96个放射敏感性调控因子(Cancer Radiosensitivity Regulation Factors, CRRF),其中CXCL8等8个基因被确定为关键预后因素。功能实验证实CXCL8敲除可显著增强放射抵抗细胞的凋亡(P<0.001),诱导G2/M期阻滞,而外源CXCL8则使亲本细胞产生放射抵抗表型。
研究采用的主要技术包括:临床剂量分次照射建立放射抵抗细胞模型(累计剂量60 Gy);克隆形成实验评估放射敏感性;流式细胞术分析细胞周期和凋亡;mRNA测序分析差异表达基因;TCGA和GTEx数据库的生物信息学分析;免疫组织化学验证CXCL8表达;以及siRNA介导的基因敲除实验。
研究结果部分显示:

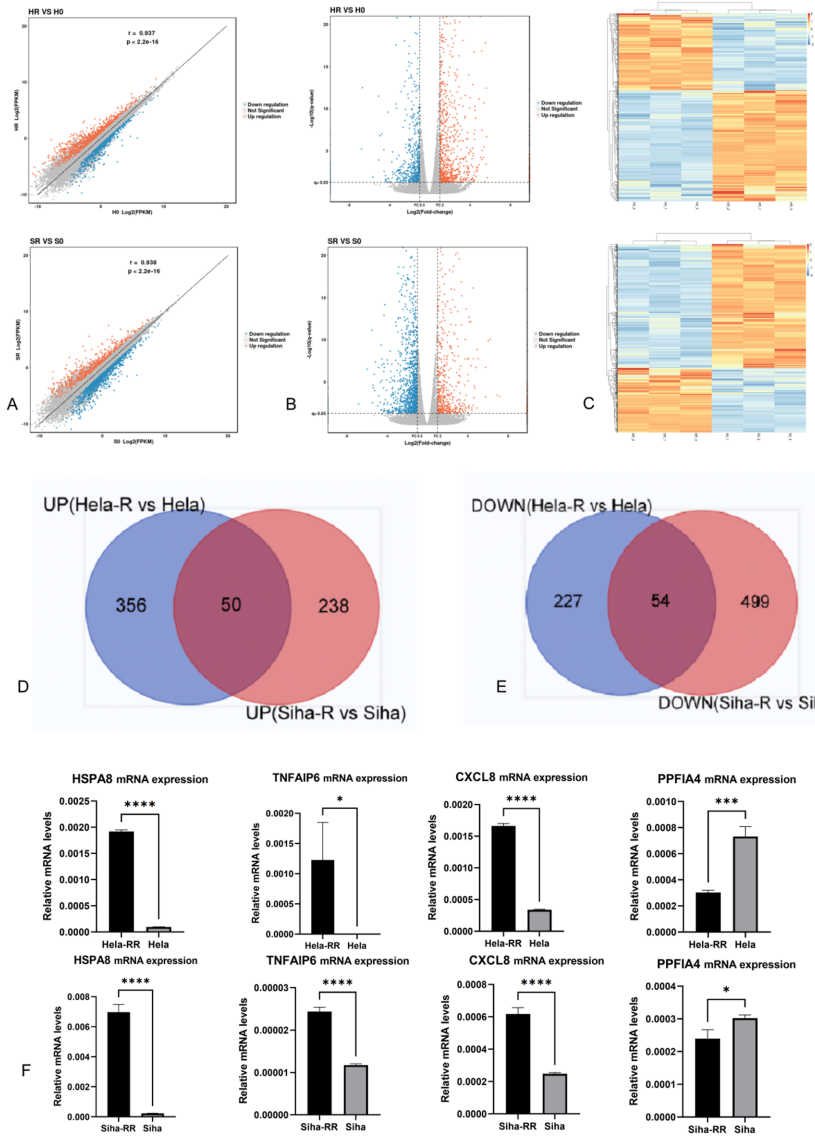


该研究首次系统阐明了CXCL8在宫颈癌获得性放射抵抗中的核心作用,揭示了CXCL8-CXCR1/2信号轴可能是通过调节肿瘤微环境(TME)中的免疫抑制和DNA损伤修复(DDR)通路来介导放射抵抗。特别值得注意的是,研究建立的临床相关性放射抵抗模型和预后评分系统为个体化放疗策略提供了工具。从转化医学角度看,靶向CXCL8的抑制剂(如Reparixin)或可成为新型放射增敏剂,与现有放化疗方案联用有望改善局部晚期宫颈癌(LACC)患者的治疗效果。这项研究不仅填补了宫颈癌放射抵抗机制研究的空白,也为其他实体瘤的放射抵抗研究提供了方法论参考。
 生物通微信公众号
生物通微信公众号
知名企业招聘