
-

生物通官微
陪你抓住生命科技
跳动的脉搏
靶向肝星状细胞的Apt-Tan递送PU.1诱饵ODN治疗小鼠肝纤维化的机制研究
【字体: 大 中 小 】 时间:2025年07月02日 来源:Molecular Therapy Nucleic Acids 6.5
编辑推荐:
本研究针对肝纤维化(LF)缺乏靶向治疗手段的难题,通过Cell-SELEX技术筛选出肝星状细胞(HSC)特异性内化DNA适配体Apt-Tan,将其与转录因子PU.1的诱饵寡脱氧核苷酸(ODN)结合,构建了Apt-Tan-PU.1 decoy ODN靶向递送系统。实验证实该复合物能选择性进入活化HSC细胞核,抑制TIMP1、α-SMA等促纤维化基因表达,显著减轻CCl4诱导的小鼠肝纤维化,为肝纤维化靶向治疗提供了新策略。
肝纤维化是慢性肝病发展的共同病理结局,可进一步恶化为肝硬化和肝癌。尽管消除病因是当前主要治疗手段,但针对肝纤维化本身的靶向药物仍属空白。作为肝纤维化的核心效应细胞,肝星状细胞(HSC)活化后分泌过量细胞外基质(ECM),同时通过组织金属蛋白酶抑制剂(TIMP1)抑制ECM降解,导致纤维化进展。然而,HSC缺乏特异性表面标志物,使得靶向治疗面临巨大挑战。
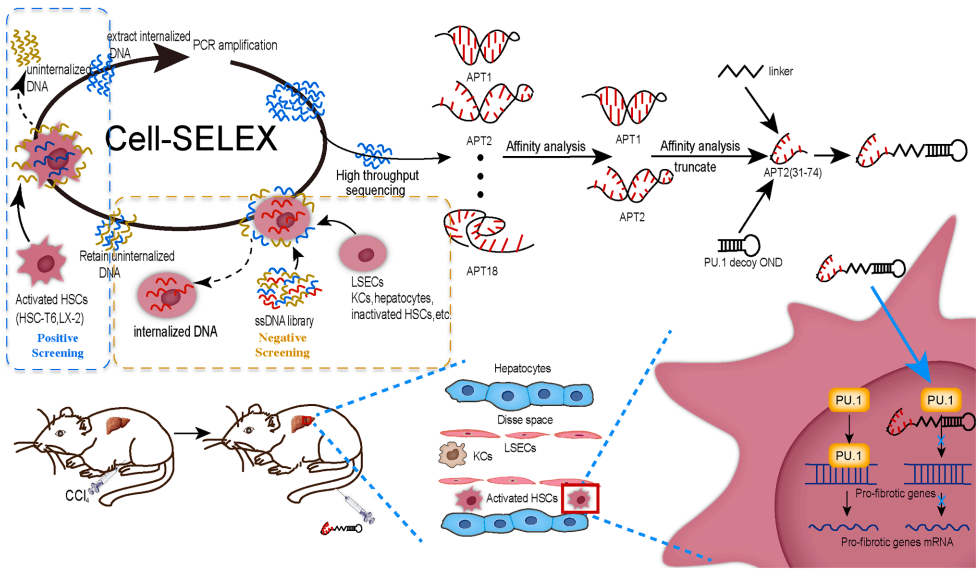
中国三峡大学的研究团队创新性地将适配体技术与转录调控策略相结合。通过Cell-SELEX技术筛选获得能特异性内化至活化HSC的DNA适配体Apt-Tan,并证实其通过网格蛋白非依赖的内吞途径进入细胞。同时,针对促纤维化关键转录因子PU.1设计诱饵寡脱氧核苷酸(decoy ODN),利用其"AGAGGAAGTG"结合序列竞争性捕获PU.1,阻断下游促纤维化基因表达。将二者通过C6连接子构建的Apt-Tan-PU.1 decoy ODN复合物,在CCl4诱导的肝纤维化小鼠模型中显示出显著疗效。该研究发表于《Molecular Therapy Nucleic Acids》,为肝纤维化治疗提供了新型靶向递送工具和治疗策略。
研究主要采用以下关键技术:1)Cell-SELEX筛选HSC特异性内化适配体;2)流式细胞术和激光共聚焦显微镜验证适配体内化特性;3)抑制剂实验分析内化机制;4)CCl4诱导的小鼠肝纤维化模型评估治疗效果;5)免疫印迹和病理染色分析纤维化标志物表达。
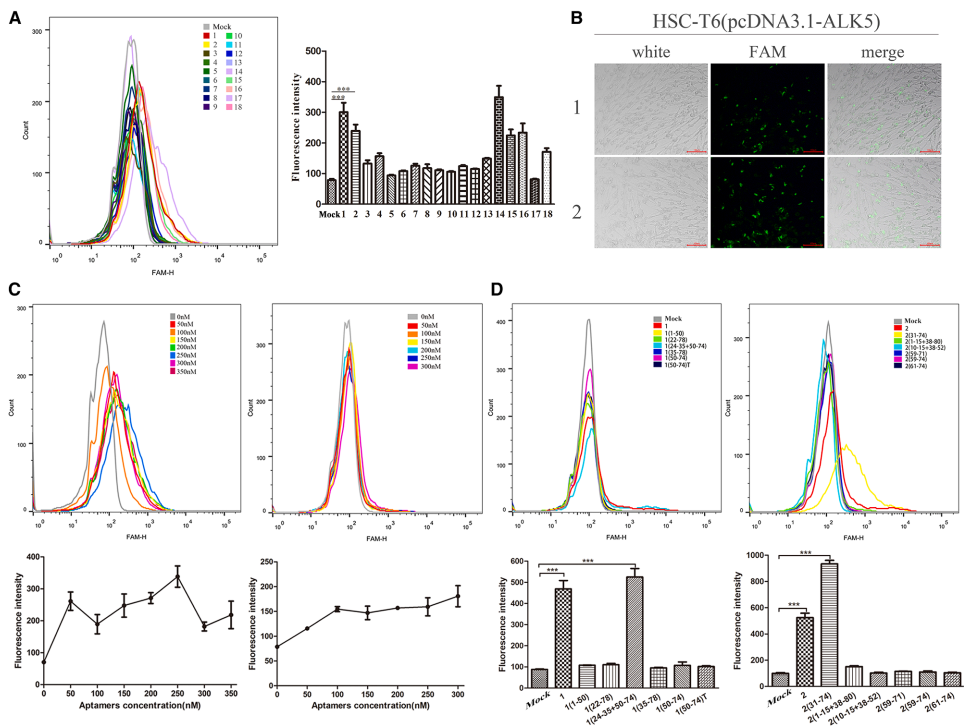
【Apt-Tan的筛选与特性】
通过11轮Cell-SELEX筛选获得18个候选适配体,其中APT1和APT2显示出最强内化能力。经截短优化后获得的Apt-Tan在400 nM浓度下达到饱和,血清半衰期约4小时,能特异性进入活化HSC-T6细胞而非其他对照细胞。抑制剂实验表明其内化依赖细胞膜蛋白受体和窖蛋白介导的内吞作用。
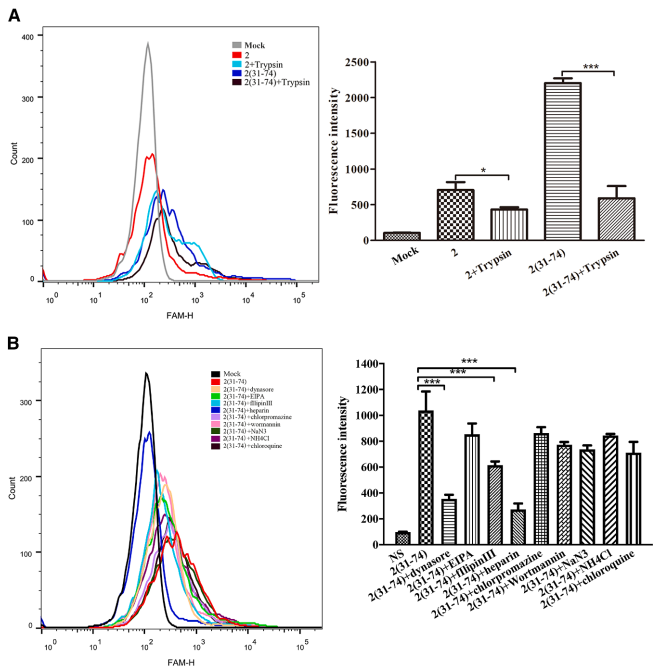
【靶向递送系统构建】
将Apt-Tan与含PU.1结合位点的双链decoy ODN连接,构建的复合物能选择性进入活化HSC细胞核,而在血清中6小时内完全降解。三维激光共聚焦显微镜证实复合物成功定位于细胞核。
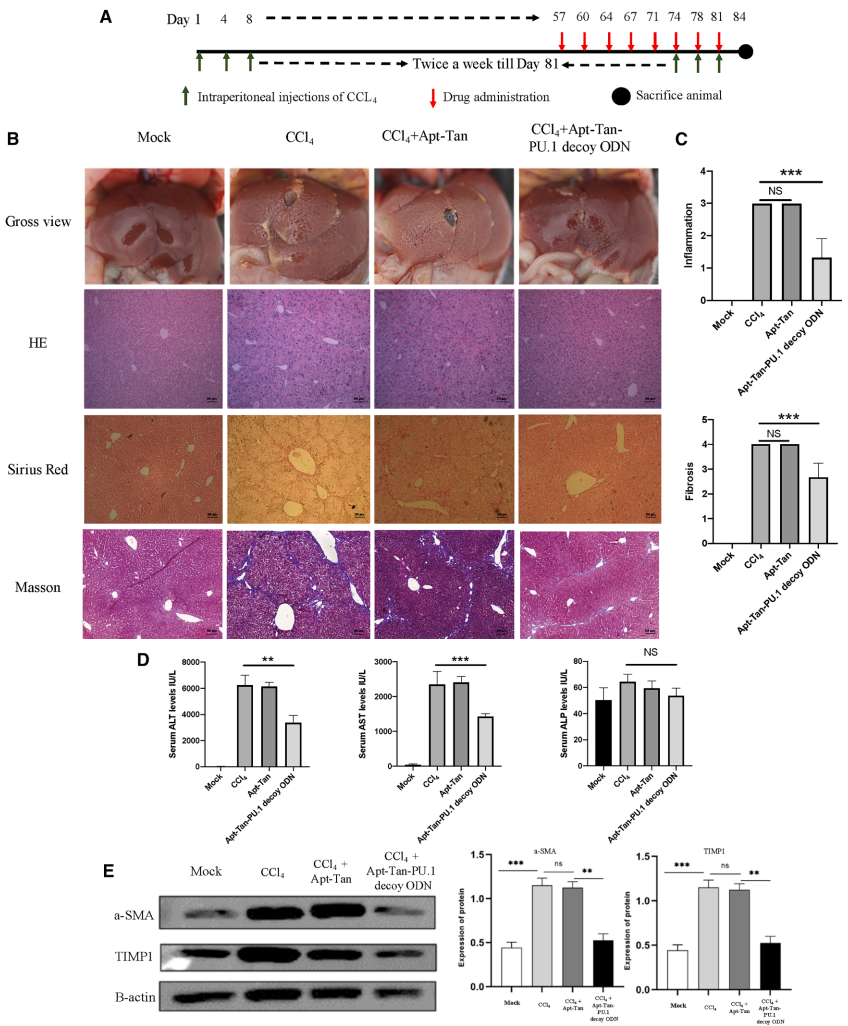
【体内治疗效果】
尾静脉注射Cy5标记的复合物1小时后主要富集于肝脏,免疫荧光显示其与活化HSC标志物α-SMA和PDGFRα共定位。治疗4周后,复合物组小鼠肝脏结节减少,胶原沉积显著减轻,血清ALT和AST水平下降,TIMP1和α-SMA表达恢复至正常水平。
该研究创新性地实现了三个突破:首先,通过Cell-SELEX绕过HSC缺乏特异性标志物的限制,获得高特异性内化适配体;其次,利用PU.1作为"先锋转录因子"的特性,通过decoy ODN阻断其调控网络;最后,DNA- DNA复合物设计避免了不同核酸类型的兼容性问题。值得注意的是,PU.1作为多效转录因子,其全身抑制可能带来副作用,而Apt-Tan的靶向性有效解决了这一难题。
研究也存在一定局限:仅使用CCl4单一模型验证,样本量较小;未单独评估PU.1 decoy ODN的疗效;对PU.1调控HSC活化的表观遗传机制阐释不足。未来研究可拓展至其他纤维化模型,优化适配体稳定性,并探索PU.1在纤维化中的转录调控网络。该靶向策略不仅适用于肝纤维化,也为其他器官纤维化治疗提供了新思路。
 生物通微信公众号
生物通微信公众号
知名企业招聘