
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:靶向免疫检查点的药物偶联物:一类用于癌症治疗的新型治疗药物
【字体: 大 中 小 】 时间:2025年07月03日 来源:npj Precision Oncology 6.8
编辑推荐:
这篇综述深入探讨了免疫检查点靶向药物偶联物(IDCs)的机制与临床进展,结合抗体-药物偶联物(ADCs)与免疫检查点抑制剂(ICIs)的双重优势,通过靶向PD-L1、B7-H3等分子重塑肿瘤微环境(TME)。文中汇总了IDCs在实体瘤中的早期试验数据,显示其对“冷肿瘤”的潜在突破性疗效,同时强调了安全性优化与生物标志物探索的重要性。
IDCs由三部分组成:靶向免疫检查点的单抗、可裂解连接子和细胞毒性载荷。其设计借鉴了传统抗体-药物偶联物(ADCs)的结构,但靶点选择转向了PD-L1、B7-H3等免疫调节分子。通过双重作用机制——既阻断免疫抑制信号(如PD-1/PD-L1通路)又释放载荷(如微管抑制剂MMAE或拓扑异构酶I抑制剂)——IDCs能直接杀伤肿瘤细胞并激活TME中的免疫应答。
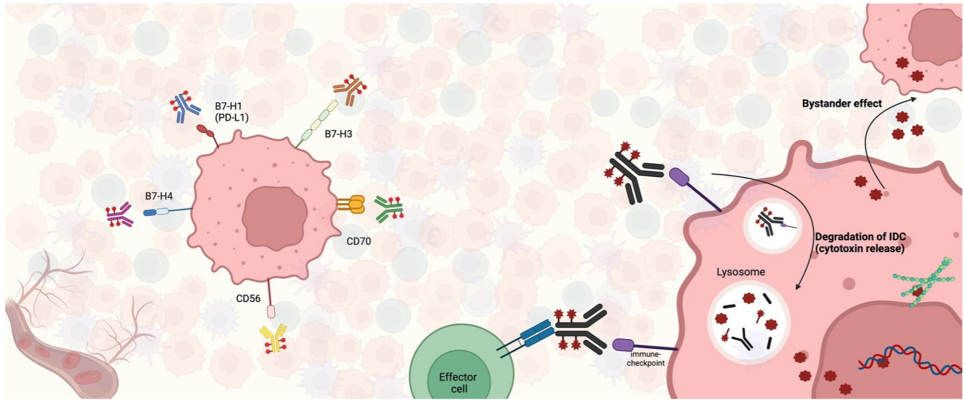
PD-L1靶向IDCs:SGN-PDL1V在头颈鳞癌(HNSCC)和非小细胞肺癌(NSCLC)中显示出12.7%的客观缓解率(ORR),且疗效与PD-L1表达无关。
B7-H3靶向IDCs:
B7-H4靶向IDCs:AZD8205在胆道癌和乳腺癌中ORR为19.5%,主要毒性为中性粒细胞减少(34%)。
IDCs的毒性谱以血液学不良事件为主(如≥G3中性粒细胞减少达20-30%),非血液学毒性如间质性肺病(ILD)罕见但需警惕。未来需优化药物-抗体比(DAR)和连接子稳定性,并探索双特异性IDCs或联合策略(如与PD-1抑制剂联用)。
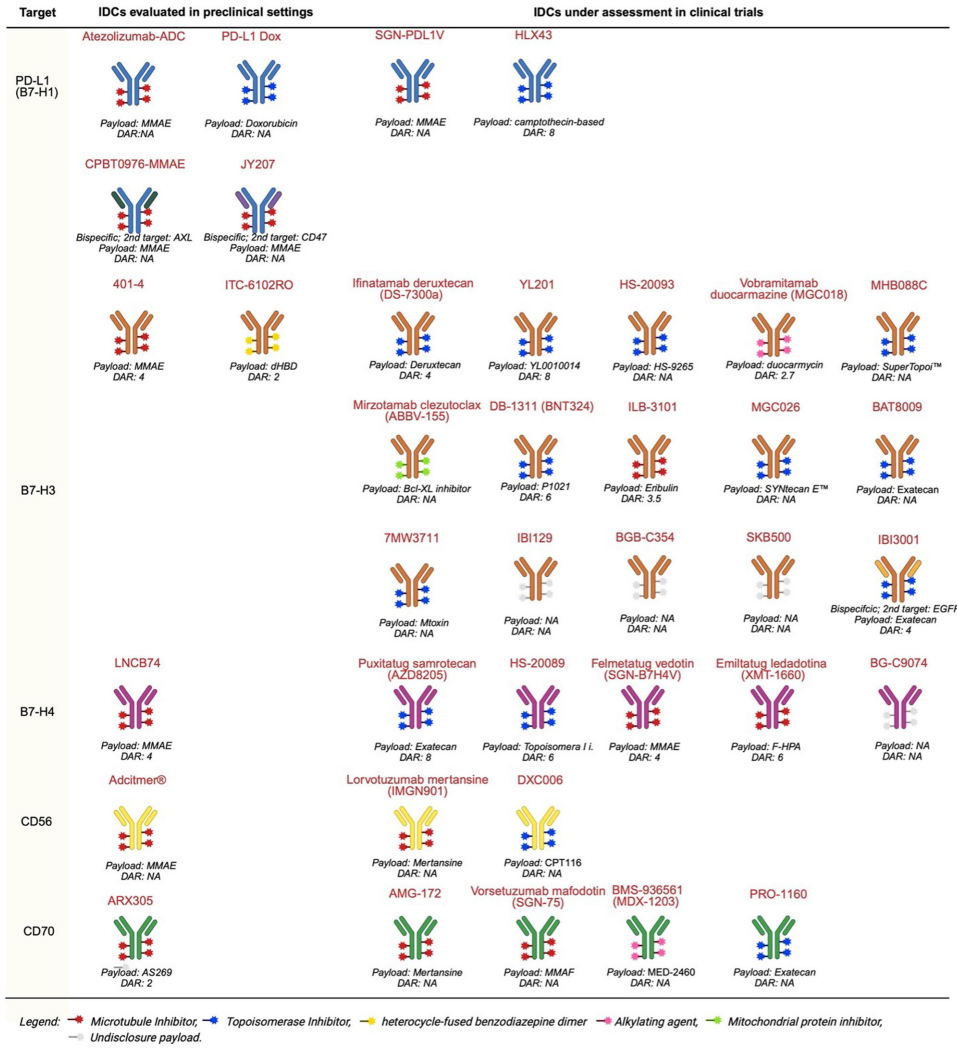
IDCs通过“免疫调节+细胞杀伤”双通路突破传统治疗瓶颈,尤其在SCLC、mCRPC等难治性肿瘤中展现前景。未来需通过III期试验验证其广谱抗肿瘤潜力,并开发基于TME特征的精准治疗策略。
 生物通微信公众号
生物通微信公众号
知名企业招聘