
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:神经酰胺在免疫中的信号传导:分子视角
【字体: 大 中 小 】 时间:2025年07月03日 来源:Lipids in Health and Disease 3.9
编辑推荐:
(编辑推荐)这篇综述系统阐述了神经酰胺(Ceramide)作为生物活性脂质在免疫调控中的核心作用,涵盖其生物合成途径、生物物理特性及通过膜动力学和结合蛋白(如CAPP、PKC-ζ)调控免疫细胞(如巨噬细胞、T细胞)功能的机制,关联炎症、代谢疾病(如肥胖、IBD)和癌症治疗靶点(如ASMase、CerS6)。
神经酰胺是鞘脂家族的核心成员,由鞘氨醇碱基与脂肪酸通过多步骤酶促反应合成。其合成起始于内质网(ER)的丝氨酸棕榈酰转移酶(SPT)催化棕榈酰-CoA与L-丝氨酸缩合生成3-酮二氢鞘氨醇,随后经CerS1-6家族酶催化酰化形成二氢神经酰胺,最终由二氢神经酰胺去饱和酶(DES)引入4,5-反式双键完成合成。值得注意的是,SPT复合物(含SPTLC1/2/3亚基)的底物灵活性允许生成非典型鞘氨醇碱基(如d16:0、d20:0),这些变体在病理条件下(如神经毒性)积累。神经酰胺还可通过鞘磷脂酶(SMase)水解鞘磷脂再生,或经溶酶体酸性神经酰胺酶(Asah1/AC)降解为鞘氨醇,进入“补救途径”循环利用。

神经酰胺的疏水性和氢键形成能力使其在膜中形成凝胶样微区(CRPs),降低流动性并促进信号分子聚集。例如,长链神经酰胺(如C16:0)通过改变线粒体膜通透性诱导细胞凋亡,而短链变体(如C2-Cer)则更易调节受体簇(如Fas/CD95)激活。胆固醇含量显著影响其作用——在胆固醇贫乏的膜中,神经酰胺更易形成功能域,进而调控CXCR4受体动态和T细胞迁移。
膜动力学调控:神经酰胺通过形成CRPs促进死亡受体(如Fas)簇集,激活caspase级联反应。在NK细胞中,CerS6衍生的C16:0-神经酰胺通过结合线粒体分裂因子(MFF)诱导线粒体碎片化,加剧肥胖相关的胰岛素抵抗。
结合蛋白互作:神经酰胺直接结合蛋白磷酸酶(PP2A)和PKC-ζ,抑制Akt通路促进凋亡。溶酶体相关蛋白LAPTM4B通过神经酰胺结合调节mTORC1信号,连接鞘脂代谢与自噬。
巨噬细胞:饱和脂肪酸(如棕榈酸)通过IRE1α-SPT轴增加神经酰胺合成,激活NLRP3炎症小体和IL-1β分泌,驱动慢性炎症。相反,IL-10通过抑制神经酰胺生成发挥抗炎作用。
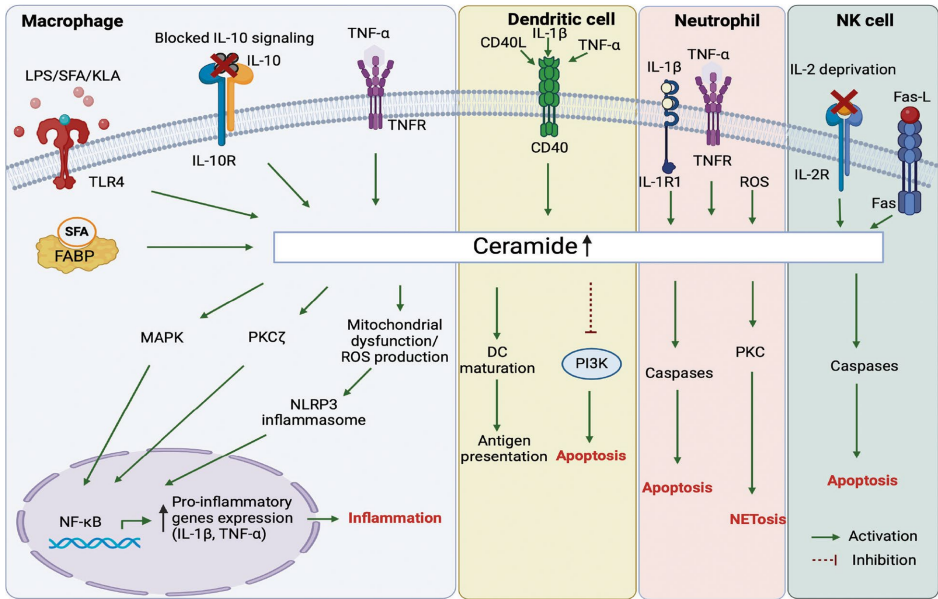
树突细胞:神经酰胺积累抑制抗原提呈(如MHC-II),而合成类似物C8-Cer可增强DC成熟,提升抗病毒T细胞反应。
中性粒细胞:SMase衍生的神经酰胺通过Rac1/2调控趋化性,其与CD300f受体互作抑制脓毒症中的过度炎症。
T细胞:TCR激活后CerS2/5上调,产生C16-C24神经酰胺,通过破坏脂筏纳米簇抑制钙信号(CRAC通道)和NFAT核转位。CerS6缺失减轻结肠炎,但削弱抗肿瘤CD8+ T细胞线粒体功能。
B细胞:BCR激活后神经酰胺/葡糖神经酰胺比例变化调控凋亡,而XBP-1依赖的神经酰胺合成促进浆细胞分化和抗体分泌。
神经酰胺代谢紊乱与肥胖相关胰岛素抵抗、动脉粥样硬化(通过CYSLTR2感知神经酰胺)和阿尔茨海默病(促进β淀粉样斑块)密切相关。靶向策略包括:
未来研究需结合单细胞脂质组学解析神经酰胺的时空动态,并开发细胞特异性递送系统以平衡免疫稳态。
 生物通微信公众号
生物通微信公众号
知名企业招聘