
-

生物通官微
陪你抓住生命科技
跳动的脉搏
"跨脑区时空图谱揭示:miRNA-mRNA昼夜节律网络在皮层-纹状体-下丘脑中的细胞特异性调控机制"
【字体: 大 中 小 】 时间:2025年07月03日 来源:Communications Biology 5.2
编辑推荐:
本研究通过高通量测序技术解析了雄性C57BL/6J小鼠大脑皮层、纹状体和下丘脑中mRNA/miRNA的昼夜节律(circadian)、超昼夜(ultradian)和亚昼夜(infradian)振荡特征,首次构建了包含12,000+节律基因的交互式数据库(https://www.ghasemloulab.ca/chronoCNS),发现静息少突胶质细胞(oligodendrocytes)具有最强节律特征,并通过免疫荧光验证了IL-33/AdipoR2等关键靶点的时空表达模式,为神经退行性疾病(如帕金森病)的昼夜干预提供新靶点。
在生命活动中,生物钟如同精密编排的交响乐指挥家,协调着基因表达的昼夜(circadian,24小时)、超昼夜(ultradian,<24小时)和亚昼夜(infradian,>24小时)节律。尽管科学家已发现约40%的小鼠蛋白编码基因具有器官特异性节律,但中枢神经系统(CNS)中仅有不足6%的基因被证实存在节律性表达,且其细胞类型特异性调控机制仍是未解之谜。更关键的是,作为重要转录后调控因子的microRNA(miRNA)如何参与这一过程,以及不同脑区(如掌管记忆的皮层、调控运动的纹状体和维持稳态的下丘脑)如何通过差异节律实现功能特化,成为神经生物学领域亟待破解的科学问题。
针对这一挑战,Queen's大学Nader Ghasemlou团队在《Communications Biology》发表重要研究。研究人员利用雄性C57BL/6J小鼠的皮层、纹状体、下丘脑和肝脏(对照)组织,通过每3小时采样(持续36小时)的高通量测序获得时空转录组数据,结合MetaCycle、RAIN和ARSER算法进行节律分析,采用WGCNA构建基因共表达网络,并通过免疫荧光显微技术验证关键靶点的细胞定位及时空表达特征。
结果部分
Distinct biological rhythms of mRNAs and miRNAs across CNS sites
研究发现皮层拥有CNS中最多的节律mRNA(12,000+),而肝脏则以24小时周期基因为主。通过RAIN算法检测到非24小时周期基因数量较传统MetaCycle算法增加5倍,提示CNS存在更复杂的超/亚昼夜调控。核心生物钟基因Bhlhe41在所有脑区均呈现节律性,而Adrb1仅皮层特异性振荡。令人惊讶的是,仅发现8个miRNA(如miR-5099、miR-124a-2)具有显著节律性,但其相位分布呈现独特的双峰模式(ZT6-12和18-24)。

Specificity of cycling genes in three CNS structures
仅有1332个mRNA和1个miRNA(miR-5099)在所有组织中节律表达。脑区共享的781个mRNA表现出显著参数差异:3955个基因存在≥6小时的相位差,其中1131个呈现反相位(antiphase)振荡。转录因子E2f3的富集提示其可能通过CRY2/E2F家族调控区域特异性节律。
Cycling genes are linked to human chronotype genetics
107个皮层节律基因与人类睡眠时型(chronotype)相关基因重叠,其中Rbm6、Fbxl4等5个基因在全部脑区保守,可能解释小鼠品系间的行为差异。
Shared and unique pathways across the CNS and period categories
24小时周期基因显著富集于自噬和内质网应激通路,而12小时周期基因在皮层纹状体中与Hippo信号传导相关。少突胶质细胞相关通路(如髓鞘形成)在28-30小时周期模块中特异性出现,暗示长周期节律对神经胶质功能的特殊调控。
Identification of mRNA-miRNA pairs and pathways across the CNS
发现5618对皮层mRNA-miRNA负相关调控对,其中50%存在miRNA先导表达模式(delay≤0),远高于肝脏(25%)。通过multiMiR数据库比对,仅少数互作对(如miR-342-Tgfbr2)被既往实验验证,凸显该领域研究空白。
Cycling genes contribute to neuroimmune interactions in the healthy state
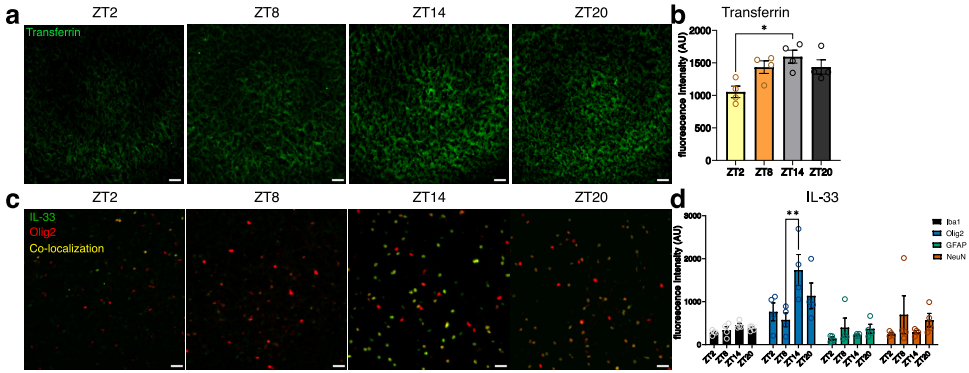
WGCNA分析显示,皮层grey60模块同时包含少突胶质细胞(Olig2)、星形胶质细胞(GFAP)和内皮细胞标记基因,其枢纽基因转铁蛋白(Transferrin)呈现典型的昼夜振荡(ZT14达峰)。免疫荧光证实IL-33在少突胶质细胞中的节律性表达,而AdipoR2在下丘脑神经元中特异性振荡,揭示神经-免疫互作的时空编码机制。
结论与展望
该研究首次绘制了CNS多脑区节律基因图谱,揭示:(1)少突胶质细胞是CNS最强的节律执行者;(2)miRNA-mRNA调控网络存在脑区特异性分层;(3)超/亚昼夜节律可能通过Hippo和RIG-1等通路参与神经可塑性调控。创建的交互式数据库为帕金森病(LRRK2节律)、脑卒中(AdipoR2振荡)等疾病的时辰治疗提供新视角。未来需在雌性模型、单细胞测序和更长采样周期(≥48小时)方向深化研究,以全面解析生物钟的神经生物学基础。
 生物通微信公众号
生物通微信公众号
知名企业招聘