
-

生物通官微
陪你抓住生命科技
跳动的脉搏
PSTPIP1在肾透明细胞癌中的高表达及其作为预后标志物与治疗靶点的潜在价值
【字体: 大 中 小 】 时间:2025年07月03日 来源:Biochemical Genetics 2.1
编辑推荐:
本研究针对肾透明细胞癌(ccRCC)缺乏有效靶向治疗的临床难题,通过多数据库联合生物信息学分析和免疫组化验证,首次揭示炎症相关蛋白PSTPIP1在ccRCC中显著高表达且与肿瘤大小、TNM分期及PD-L1状态显著相关。研究发现PSTPIP1过表达是患者总生存期缩短的独立危险因素,其共表达基因ACAP1/CORO1A/DEF6及调控的细胞粘附分子(CAMs)、NK细胞毒性等通路为ccRCC免疫治疗提供新靶点,发表于《Biochemical Genetics》的成果为ccRCC预后评估和精准治疗开辟新思路。
肾细胞癌是全球范围内威胁人类健康的重大疾病,其中透明细胞亚型(ccRCC)占所有病例的70%,每年导致超10万人死亡。尽管靶向PD-1/PD-L1的免疫疗法取得进展,但耐药性和缺乏有效预后标志物仍是临床痛点。值得注意的是,炎症与肿瘤微环境的相互作用已被证实是ccRCC进展的关键推手,而调控免疫应答的PSTPIP1(proline-serine-threonine phosphatase-interacting protein 1)在自身炎症性疾病中作用明确,但其在ccRCC中的角色仍属未知。
为破解这一科学问题,浙江中医药大学附属人民医院泌尿肾病中心团队开展了一项整合生物信息学与临床验证的研究。通过TCGA、Oncomine等5大数据库分析533例ccRCC样本,结合150例临床标本的免疫组化检测,首次系统阐明了PSTPIP1作为ccRCC不良预后因子的临床价值及其分子机制。论文发表于《Biochemical Genetics》,为ccRCC的精准诊疗提供了新视角。
研究采用三大关键技术:1)多数据库联合分析(TCGA、GEPIA等)筛选PSTPIP1表达谱;2)150例ccRCC患者组织芯片(TMA)的免疫组化验证;3)LinkedOmics平台进行共表达基因及通路富集分析。样本来自浙江省人民医院手术切除的肿瘤及27例癌旁正常组织,经伦理审查(QT2025023)并获患者知情同意。
PSTPIP1在ccRCC中显著高表达
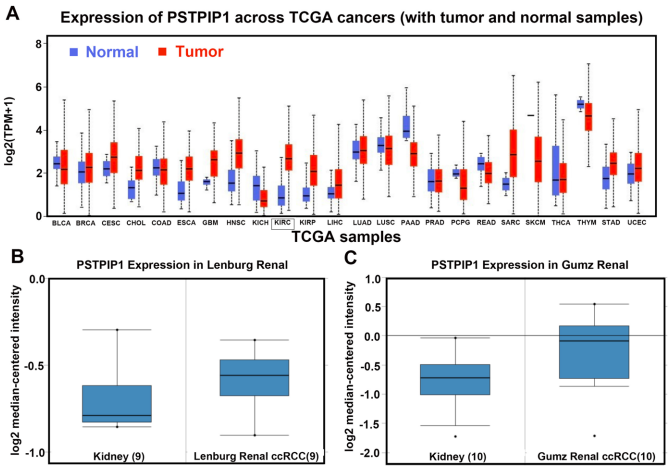
PSTPIP1与临床病理特征显著相关
高表达组肿瘤直径≥5cm比例达60%(低表达组36.5%),III-IV期占比40%(低表达组24.7%),且PD-L1阳性率升高至58.5%(P均<0.05)。多因素Cox回归显示PSTPIP1虽非独立预后因子(HR=1.349),但与Fuhrman分级、TNM分期协同影响患者生存。
共表达网络揭示作用机制
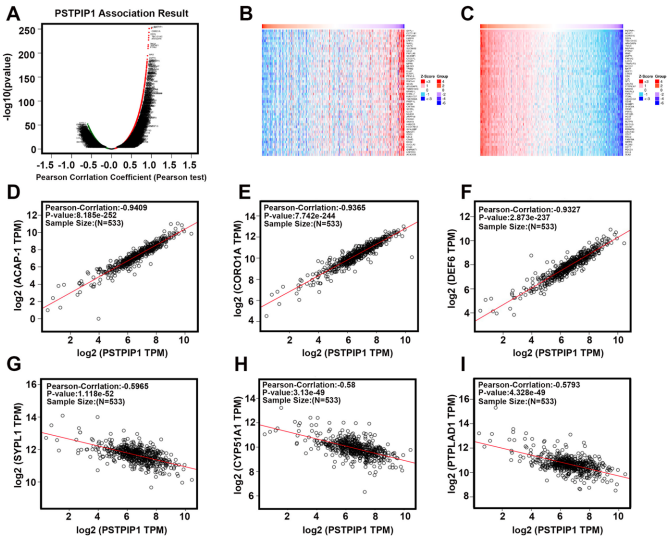
这项研究具有三重转化医学价值:首先,证实PSTPIP1可作为ccRCC预后评估的新型分子标志物;其次,发现其通过调控免疫微环境促进肿瘤进展的机制;最后,为开发靶向PSTPIP1及其下游通路(如ACAP1-ARF6轴)的联合治疗策略提供理论依据。尽管Oncomine数据库停用可能影响后续验证,但整合临床样本与多组学数据的创新研究模式,为探索肿瘤-免疫交叉靶点树立了新范式。
 生物通微信公众号
生物通微信公众号
知名企业招聘