
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:甲状腺激素信号在眼部发育和疾病中的作用
【字体: 大 中 小 】 时间:2025年07月03日 来源:Biological Research 4.3
编辑推荐:
这篇综述系统阐述了甲状腺激素(TH)信号通路在眼部发育和病理过程中的核心作用,重点解析了TH通过甲状腺激素受体(TRs)和脱碘酶(DIOs)调控视网膜光感受器分化、角膜透明性维持及眼眶组织稳态的分子机制。文章创新性地提出TH信号异常与糖尿病视网膜病变(DR)、年龄相关性黄斑变性(AMD)、甲状腺相关眼病(TAO)等疾病的关联,并探讨了靶向TSHR/IGF-1R轴和TRβ特异性激动剂等新型治疗策略的转化潜力。
甲状腺激素(T3/T4)的合成受下丘脑-垂体-甲状腺轴(HPT)精密调控,其中游离T3作为主要活性形式通过有机阴离子转运肽(OATP1C1)等跨膜转运体进入细胞。局部TH浓度由脱碘酶家族(DIO1/DIO2/DIO3)动态调节——DIO2催化T4转化为活性T3,而DIO3通过生成反向T3(rT3)实现信号衰减。这种时空特异性调控使眼部组织能独立于循环TH水平自主适应微环境需求。

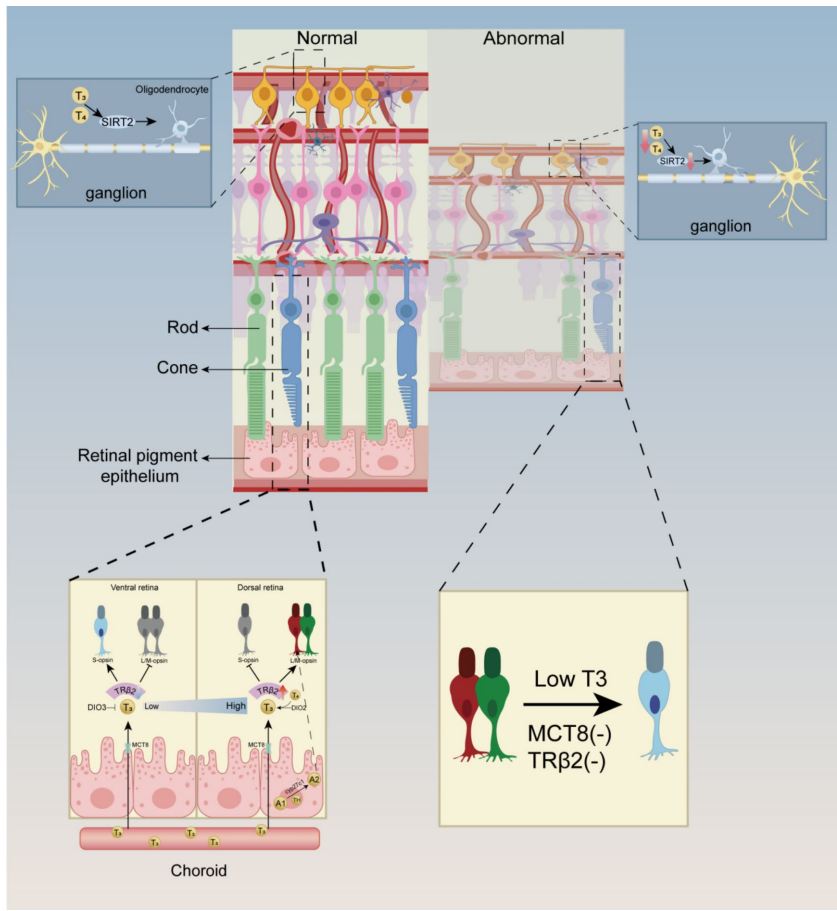
在视网膜发育过程中,TH通过TRβ2受体决定视锥细胞亚型命运:低T3环境促进S-视蛋白表达,而高T3驱动M/L-视蛋白分化。人类视网膜类器官研究显示,DIO3在早期抑制TH信号维持祖细胞增殖,后期DIO2主导的T3生成触发光感受器成熟。先天性甲减大鼠模型中出现视网膜变薄和光感受器外节发育障碍,印证了TH对神经视网膜层形成的必要性。
角膜发育中,T4通过上调角质硫酸蛋白聚糖(KSPG)基因促进基质脱水,而T3加速三叉神经环形成,二者协同建立角膜透明性和神经支配模式。
甲状腺功能异常显著影响角膜稳态:甲亢患者角膜变薄与圆锥角膜风险增加3倍,而甲减导致可逆性角膜增厚。机制上,T4通过上调角膜成纤维细胞胶原I表达改变细胞外基质(ECM)组成。泪液中T4水平升高可能通过整合素αvβ3/PKD/HDAC5通路驱动病理性血管生成。
在干眼症(DED)中,TSHR在泪腺的异常表达引发自身免疫攻击,而TRβ过表达抑制胆碱能神经递质释放,共同导致泪液分泌减少。MCT8转运体缺陷小鼠模型显示,RPE细胞TH摄取障碍会引发类似甲减的视锥细胞亚型转换。
糖尿病视网膜病变(DR)患者存在视网膜局部T3缺乏,高糖环境通过抑制DIO2使T4/T3转化率下降60%。补充T3可逆转高糖诱导的内皮细胞凋亡,其保护作用与抑制线粒体ROS生成相关。年龄相关性黄斑变性(AMD)患者血清游离T4水平升高,遗传学研究证实FT4水平与晚期AMD风险正相关。值得注意的是,TRβ敲除小鼠表现出RPE细胞和视锥细胞特异性保护效应,提示靶向TR亚型的选择性调控价值。
甲状腺相关眼病(TAO)的核心在于TSHR与IGF-1R的交叉对话:Graves病免疫球蛋白通过TSHR激活眼眶成纤维细胞,上调透明质酸合成酶(HAS2)促进糖胺聚糖沉积。新型单抗Teprotumumab通过阻断IGF-1R使突眼改善率达83%,而小分子拮抗剂K1-70可直接抑制TSHR信号传导。
靶向DIOs的局部调控展现独特优势:AAV载体递送DIO3基因使视网膜变性模型视锥细胞存活率提升40%,而碘泛酸(DIO2抑制剂)滴眼液可穿透血-视网膜屏障。TRβ选择性激动剂Resmetirom通过改善上皮线粒体功能抑制肺纤维化的成功案例,为TH类似物在角膜瘢痕治疗中的应用提供借鉴。TSHR抗原肽ATX-GD-59在I期临床试验中诱导免疫耐受,为自身免疫性眼病提供非免疫抑制疗法选择。

该领域仍存在关键挑战:缺乏反映眼部TH活性的特异性生物标志物,且TRβ激动剂在视网膜高表达可能引发非预期效应。未来研究需结合纳米载体递送和单细胞测序技术,实现TH信号的细胞类型特异性精准调控。
 生物通微信公众号
生物通微信公众号
知名企业招聘