
-

生物通官微
陪你抓住生命科技
跳动的脉搏
胶质母细胞瘤中发现新型IDH非依赖性高甲基化表型与星形胶质细胞样状态相关
【字体: 大 中 小 】 时间:2025年07月04日 来源:Genome Biology 10.1
编辑推荐:
本研究揭示了胶质母细胞瘤中一种独立于IDH突变的新型CpG岛甲基化表型(RTK2-CIMP),该表型通过靶向神经元发育基因的表观遗传沉默,促进肿瘤细胞向星形胶质细胞样状态转化。德国癌症研究中心团队整合全基因组甲基化测序(WGBS)和单细胞转录组分析,发现RTK2-CIMP具有独特的H3K27me3/H3K4me1双价染色质特征,为理解肿瘤细胞可塑性提供了新视角。
在恶性脑肿瘤研究领域,胶质母细胞瘤(Glioblastoma, GBM)因其侵袭性和治疗抵抗性始终是医学界的重大挑战。这类肿瘤存在显著的分子异质性,其中IDH突变相关的CpG岛甲基化表型(G-CIMP)已被广泛研究,但占临床多数病例的IDH野生型肿瘤的表观遗传特征仍不明确。更令人困惑的是,这些肿瘤表现出惊人的细胞状态可塑性,能够在不同分化状态间转换,这种特性与治疗失败和复发密切相关。
德国癌症研究中心(DKFZ)联合海德堡大学的研究团队在《Genome Biology》发表的重要工作中,通过多组学分析揭开了这个谜题的关键部分。研究人员发现IDH野生型胶质母细胞瘤中存在全新的RTK2亚型特异性甲基化表型(RTK2-CIMP),这种表观遗传程序不同于经典的IDH-CIMP,而是通过锁定神经元发育基因的表观沉默,将肿瘤细胞"禁锢"在星形胶质细胞样状态,从而塑造了肿瘤的细胞组成和治疗响应特征。
研究采用60例全基因组甲基化测序(WGBS)数据系统分析四种GBM亚型的甲基化差异,结合染色质免疫沉淀测序(ChIP-seq)和单细胞RNA测序(scRNA-seq)解析表观遗传调控机制。通过随机森林分类器和贝叶斯网络建模,追溯了肿瘤甲基化特征在神经前体细胞(NP)中的表观遗传预决定现象。实验部分利用小鼠GBM模型进行Sox10基因敲除验证。
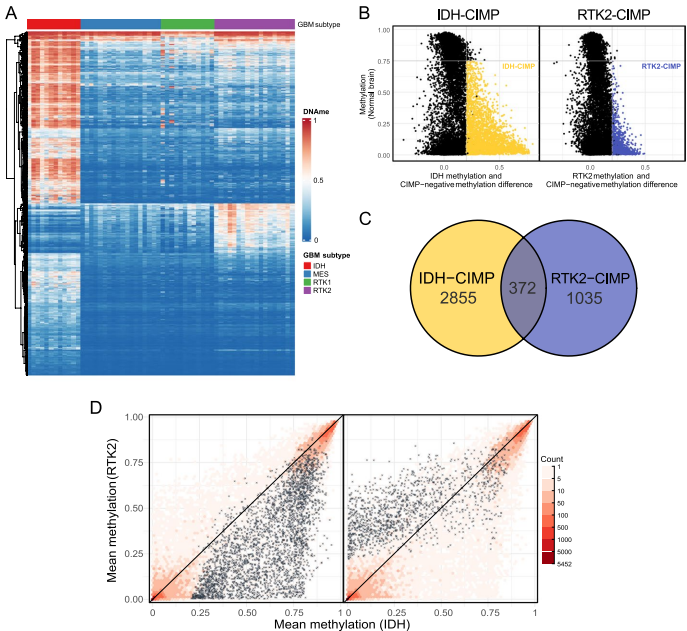
研究首先通过全基因组甲基化图谱发现RTK2亚型特异的1407个高甲基化CpG岛(RTK2-CIMP),与IDH-CIMP在基因组分布和功能上存在显著差异。这些区域在正常神经前体细胞中呈现H3K27me3(多梳蛋白抑制标记)和H3K4me1(增强子标记)共存的"双价染色质"特征。当肿瘤发生时,H3K27me3的丢失被DNA高甲基化替代,形成表观遗传"代偿机制"。

关键发现是RTK2-CIMP特异性靶向NEUROG1、EBF1等神经元分化基因。单细胞发育轨迹分析显示,这些基因在正常神经元分化过程中活跃表达,而在RTK2肿瘤中被显著抑制。这种定向沉默导致肿瘤细胞无法向神经元前体样(NPC-like)和少突胶质前体样(OPC-like)状态分化,转而富集星形胶质细胞样(AC-like)状态——这与临床常见的EGFR扩增亚型特征高度吻合。

机制上,Sox10基因(少突胶质细胞分化关键调控因子)的敲除实验证实,该因子缺失可诱导RTK2-CIMP样甲基化模式,并驱动细胞向AC-like状态转化。这一发现为理解GBM细胞状态转换提供了实验依据,表明转录因子网络与表观遗传修饰存在级联调控关系。

这项研究的重要意义在于:首次系统描绘了IDH野生型GBM的表观遗传景观,提出"双价染色质塌陷"模型解释肿瘤细胞状态锁定现象。临床转化方面,RTK2-CIMP评分与患者生存期显著相关,为预后评估提供了新指标。更深远的是,该研究揭示的表观遗传可塑性机制可能普遍存在于其他恶性肿瘤中,为开发靶向表观遗传重编程的治疗策略奠定理论基础。
 生物通微信公众号
生物通微信公众号
知名企业招聘