
-

生物通官微
陪你抓住生命科技
跳动的脉搏
前列腺癌淋巴转移新机制:细胞外囊泡circPDLIM5通过hnRNPA2B1/YY1-PROX1轴促进淋巴管生成
【字体: 大 中 小 】 时间:2025年07月04日 来源:Journal of Experimental & Clinical Cancer Research 11.4
编辑推荐:
本研究揭示前列腺癌(PCa)淋巴转移的VEGF-C非依赖新机制,发现肿瘤来源细胞外囊泡(EVs)携带的环状RNA circPDLIM5通过hnRNPA2B1介导的包装入EVs,经YY1转录因子激活PROX1表达,促进淋巴管生成和淋巴结转移。该发现为PCa淋巴转移诊断和治疗提供新靶点。
前列腺癌是全球男性第二大常见恶性肿瘤,其中淋巴结(LN)转移是导致患者预后不良的关键因素。虽然血管内皮生长因子C(VEGF-C)被认为是淋巴管生成的主要调控因子,但临床上约30%的淋巴结转移病例并不伴随VEGF-C高表达,暗示存在未知的分子机制。细胞外囊泡(EVs)作为肿瘤微环境中的重要信使,可通过传递生物活性分子重塑转移前微环境,但其在前列腺癌淋巴转移中的作用机制尚不明确。与此同时,环状RNA(circRNA)因其特殊的闭合环状结构和高度稳定性,正成为肿瘤研究的新热点。
为探索这一科学问题,来自佛山第一人民医院和上海交通大学医学院附属第九人民医院的研究团队在《Journal of Experimental 》发表重要成果。研究人员通过对327例前列腺癌患者的组织样本和体液EVs进行系统分析,结合体内外功能实验,首次揭示EVs携带的circPDLIM5通过hnRNPA2B1/YY1-PROX1信号轴促进淋巴管生成的分子机制。该研究不仅发现circPDLIM5可作为前列腺癌淋巴转移的新型生物标志物,更为VEGF-C非依赖的淋巴转移机制提供了理论依据。
研究采用多组学技术联用的策略:通过高通量RNA测序筛选出与淋巴转移相关的circPDLIM5;利用透射电镜和纳米颗粒追踪分析(NTA)表征EVs特征;建立裸鼠腘窝淋巴结转移模型进行体内功能验证;采用RNA pull-down联合质谱分析鉴定circPDLIM5互作蛋白;通过染色质免疫共沉淀(ChIP)和RNA免疫共沉淀(RIP)等技术阐明YY1-PROX1调控机制。临床样本来源于327例接受根治性前列腺切除术的患者队列,包括62例LN阳性和265例LN阴性病例。
【circPDLIM5的鉴定与特征】
研究团队通过测序发现circPDLIM5(hsa_circ_0004028)在LN阳性患者尿EVs中显著高表达。该circRNA源自PDLIM5基因的3-8外显子,经Sanger测序验证其环状结构。RNase R消化实验证实circPDLIM5较线性RNA更稳定,细胞定位分析显示其主要分布于细胞质。在327例临床样本中,circPDLIM5表达与淋巴管密度(LYVE-1标记)呈正相关,但与VEGF-C无显著关联,提示其作用不依赖VEGF-C通路。
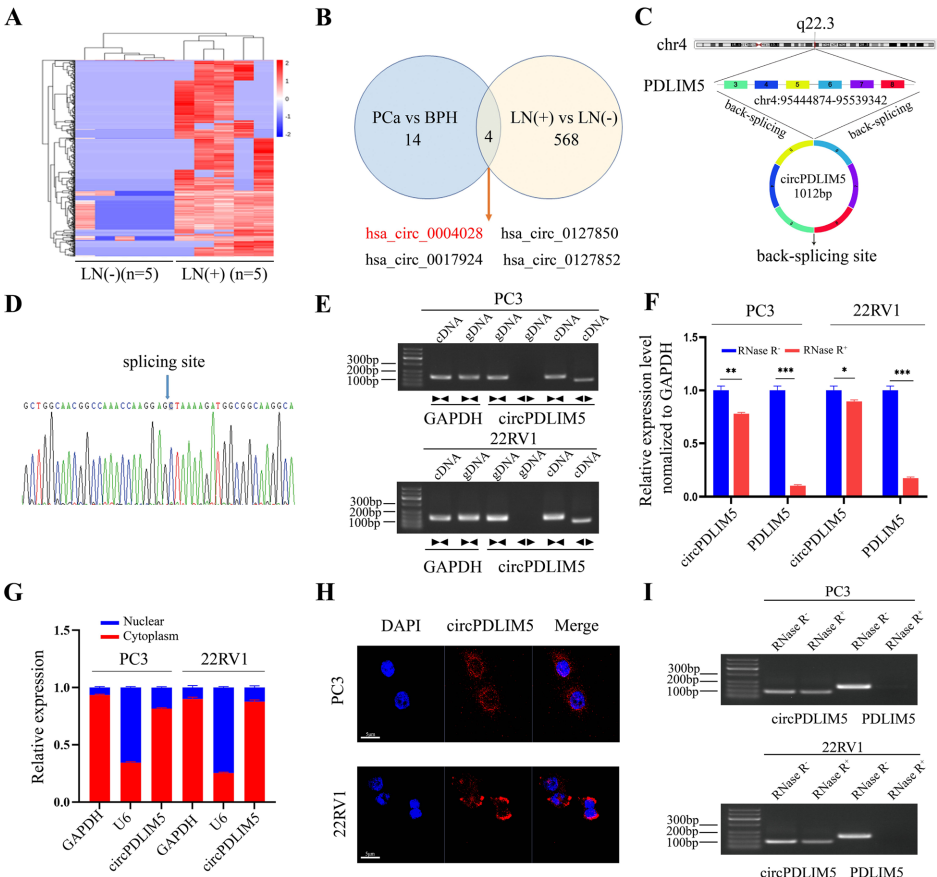
【EVs介导的淋巴转移机制】
研究发现PCa细胞分泌的EVs可被人类淋巴内皮细胞(HLECs)内化,促进其管腔形成和迁移。通过构建稳定敲低/过表达circPDLIM5的细胞株,证实EVs-circPDLIM5能显著增强裸鼠淋巴结转移,使淋巴结体积和重量增加约2倍,而皮下移植瘤模型显示其对原发瘤生长无影响。机制上,RNA结合蛋白hnRNPA2B1通过识别circPDLIM5的GGAG基序,特异性将其包装入EVs。突变该结合位点可显著减少circPDLIM5在EVs中的富集。

【YY1-PROX1调控轴的发现】
质谱分析揭示EVs-circPDLIM5在HLECs中与转录因子YY1直接互作。通过catRAPID预测和突变验证,确定695-710 nt区域为关键结合位点。染色质分离RNA纯化(ChIRP)实验显示,circPDLIM5可募集YY1至PROX1启动子区(-1813--1751 bp),增强组蛋白标记H3K27Ac和H3K4me3的富集,从而激活PROX1转录。PROX1作为淋巴管发育的关键调控因子,其过表达可逆转sh-circPDLIM5对淋巴管生成的抑制作用。

【临床转化价值】
研究证实尿和血清EVs-circPDLIM5水平与组织表达高度一致,在LN阳性患者中显著升高。受试者工作特征(ROC)曲线分析显示,其诊断LN转移的AUC达0.89,优于传统影像学检查。生存分析表明,EVs-circPDLIM5高表达患者5年无进展生存率降低40%。71.1%的MRI假阴性病例可通过EVs-circPDLIM5准确识别。
该研究首次系统阐明EVs-circPDLIM5/hnRNPA2B1/YY1-PROX1轴在前列腺癌淋巴转移中的作用,突破传统VEGF-C中心理论的局限。不仅为淋巴转移提供新的分子标志物,更启示通过靶向circPDLIM5包装(如干扰hnRNPA2B1结合)或阻断YY1-PROX1信号(如设计竞争性RNA药物)的治疗新策略。由于EVs具有天然生物相容性和靶向性,基于工程化EVs的circPDLIM5抑制剂可能成为极具前景的精准治疗手段。研究团队指出,未来需进一步探索circPDLIM5在其他肿瘤淋巴转移中的普适性,以及其与现有抗VEGF疗法的协同效应。
 生物通微信公众号
生物通微信公众号
知名企业招聘