
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:克罗恩病中全肠内营养的治疗机制
【字体: 大 中 小 】 时间:2025年07月04日 来源:Seminars in Immunopathology 7.9
编辑推荐:
这篇综述深入探讨了全肠内营养(EEN)作为儿童克罗恩病(pCD)一线疗法的多维度机制,重点解析了EEN通过重塑肠道菌群(如减少变形菌门)、调控上皮屏障功能(如紧密连接修复)及免疫代谢(如SCFAs、胆汁酸代谢)诱导缓解的协同作用。文中特别强调了EEN对线粒体功能(如PGC1α上调)、色氨酸代谢(如kynurenine通路抑制)的调控,并指出临床响应与菌群-宿主互作的个体化差异,为靶向干预提供了新视角。
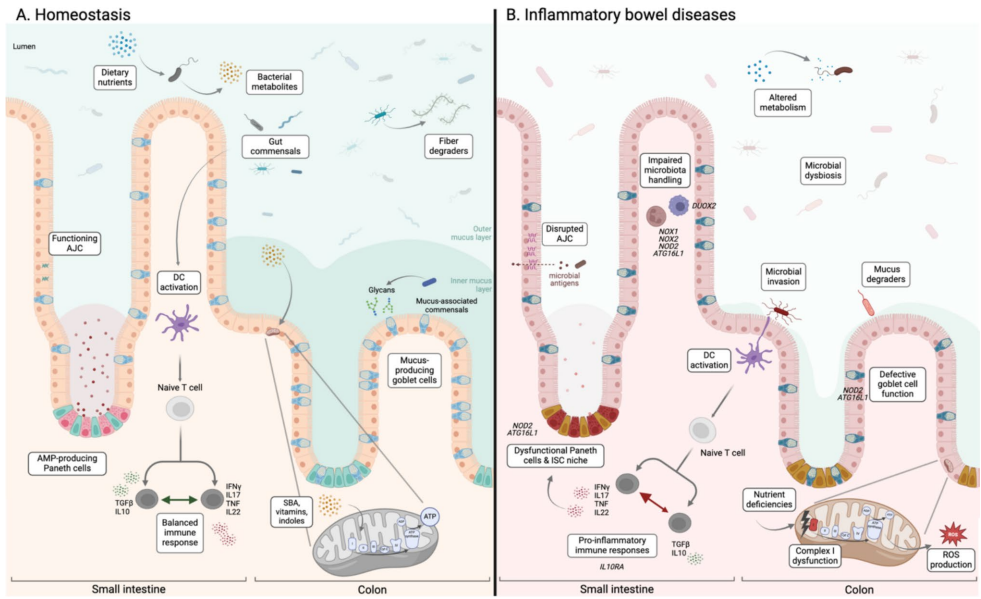
克罗恩病(CD)是一种慢性复发性胃肠道炎症性疾病,25%患者在17岁前确诊为儿科CD(pCD),其病程更凶险且伴随生长障碍等并发症。全球流行病学显示,工业化国家发病率趋稳,而亚洲新兴国家呈上升趋势。遗传因素(如NOD2、ATG16L1等400余个风险位点)与环境因素(如饮食、菌群)共同驱动疾病发生。
肠道菌群失调:CD患者表现为微生物多样性降低,肠杆菌科(如大肠杆菌)和黏液降解菌(Ruminococcus gnavus)增多,而保护性菌群(如Faecalibacterium prausnitzii)减少。
上皮屏障缺陷:包括黏液层变薄(杯状细胞减少)、紧密连接破坏及Paneth细胞功能障碍,导致病原体渗透和免疫激活。
免疫代谢紊乱:线粒体功能受损(如ETC复合体I活性下降)和代谢产物异常(如SCFAs减少、初级胆汁酸积累)加剧炎症。
作为pCD诱导缓解的一线疗法,EEN疗效与糖皮质激素相当,但黏膜愈合率更高(80% vs 17%)。其液态配方(含中链脂肪酸MCFAs)可减少机械应力,缓解肠腔扩张相关的IL-6/Th17炎症反应。
EEN通过排除膳食纤维,抑制SFB等病原体定植,同时增加蛋白发酵产物异丁酸盐(isobutyrate)和次级胆汁酸(如LCA)。临床研究显示,应答者菌群中Akkermansia muciniphila增多,而复发者则以变形菌门为主。
线粒体修复:EEN提升维生素B族水平,增强PGC1α介导的线粒体生物合成,改善ATP产能。
色氨酸代谢:EEN降低炎症相关kynurenine,增加褪黑素,通过AhR受体调节肠神经蠕动。
免疫重编程:次级胆汁酸(如3-oxoLCA)抑制Th17分化,TGR5/FXR激活促进Treg细胞增殖,协同抑制IL-6/TNFα释放。
尽管EEN疗效显著,但菌群响应异质性高(如NOD2基因型影响复发率),且纤维缺乏可能削弱黏液屏障。未来需结合多组学(如宏基因组、代谢组)探索个体化营养策略,并开发模拟EEN效应的精准膳食(如CDED)。

 生物通微信公众号
生物通微信公众号
知名企业招聘