
-

生物通官微
陪你抓住生命科技
跳动的脉搏
伏隔核中LEAP2的发现及其在苯丙胺诱导运动活动中的状态依赖性调控作用
【字体: 大 中 小 】 时间:2025年07月04日 来源:Molecular Brain 3.3
编辑推荐:
本研究首次在伏隔核(NAcc)中可视化肝脏表达抗菌肽2(LEAP2)的蛋白表达,并揭示其对苯丙胺(AMPH)诱导运动活动的调控具有状态依赖性特征。研究人员通过免疫荧光技术确认LEAP2在NAcc神经元(尤其是中型多棘神经元MSNs)中的定位,结合微注射实验发现LEAP2可剂量依赖性地抑制急性AMPH诱导的运动亢进,但该效应在慢性AMPH暴露后消失。该成果发表于《Molecular Brain》,为理解神经肽在药物成瘾中的动态调控提供了新视角。
研究背景与意义
大脑的奖赏环路是理解成瘾行为的关键,其中伏隔核(NAcc)作为核心枢纽,通过多巴胺信号调控对自然奖励(如食物)和成瘾性物质(如苯丙胺AMPH)的反应。AMPH通过升高NAcc内多巴胺水平引发运动亢进,这一现象是评估药物神经可塑性和成瘾潜力的重要指标。有趣的是,食欲调节神经肽(如胃饥饿素ghrelin)能通过生长激素促分泌素受体(GHSR)增强AMPH效应,但其内源性拮抗剂LEAP2的作用机制尚属空白。
关键科学问题
研究团队与方法
韩国延世大学医学院的研究团队结合免疫荧光染色、NAcc靶向微注射和定量PCR技术,系统分析了LEAP2的神经定位及其在急/慢性AMPH暴露模型中的行为学效应。实验采用雄性Sprague-Dawley大鼠,通过立体定位手术植入NAcc导管,分别检测急性(单次AMPH)和慢性(四次AMPH+两周戒断)给药后LEAP2微注射对运动活性的影响。
主要结果
1. LEAP2在NAcc的神经元特异性表达
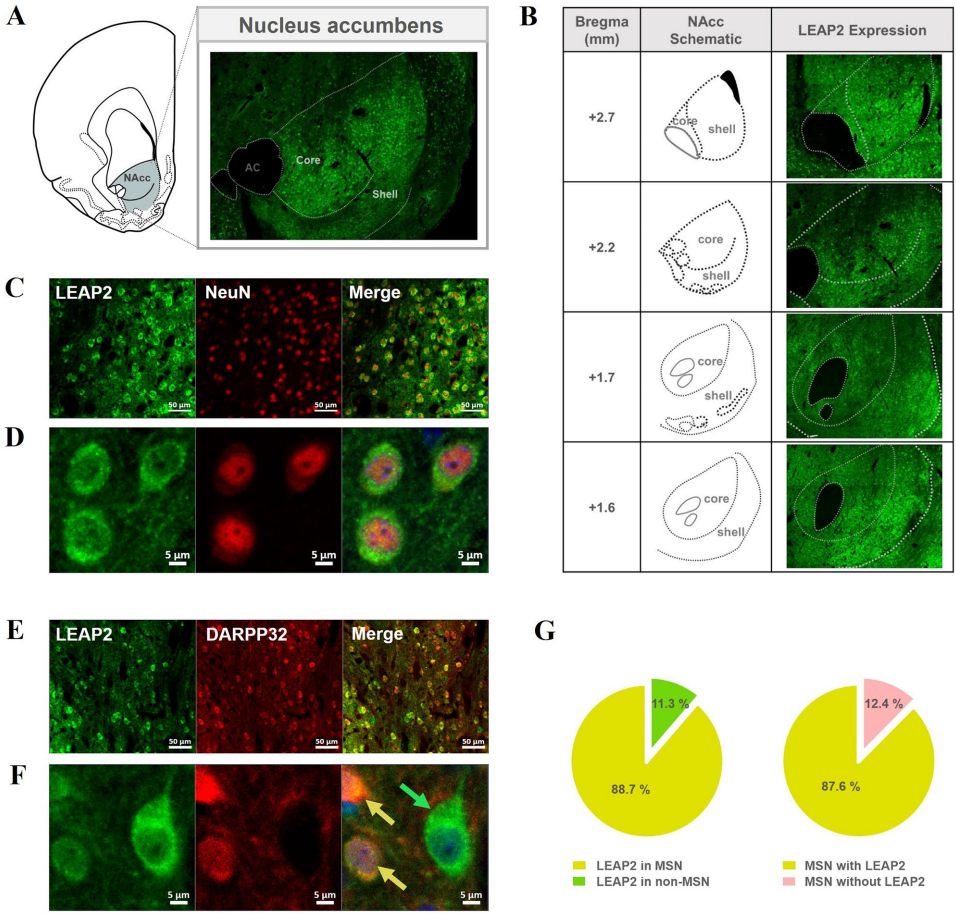
2. LEAP2对AMPH诱导运动活性的调控

3. 慢性AMPH对LEAP2表达的长期影响
讨论与意义
该研究首次揭示LEAP2-GHSR系统在NAcc中的状态依赖性调控机制:
局限性包括:
这项研究为开发基于神经肽的状态依赖性成瘾干预策略提供了新靶点,同时提示慢性药物暴露可能通过表观遗传机制(如DNA甲基化)导致LEAP2持续沉默,这将成为后续研究的重要方向。
 生物通微信公众号
生物通微信公众号
知名企业招聘