
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Orientia tsutsugamushi通过自转运蛋白ScaC激活BICD衔接子驱动动力蛋白介导的胞内迁移机制
【字体: 大 中 小 】 时间:2025年07月04日 来源:Nature Communications 14.7
编辑推荐:
本研究揭示了Orientia tsutsugamushi利用其表面自转运蛋白ScaC招募宿主细胞动力蛋白(dynein)衔接子BICD1/2,通过解除BICD2自抑制构象激活dynein-dynactin复合体组装,实现细菌向核周区的定向迁移。该发现首次阐明革兰阴性菌直接劫持微管运输系统的分子机制,为理解病原体胞内传播及开发靶向疗法提供新思路。
在病原体与宿主的进化博弈中,许多胞内细菌发展出操纵宿主细胞骨架的高效策略。立克次体科成员Orientia tsutsugamushi作为恙虫病的致病源,突破传统认知——不同于依赖肌动蛋白的“火箭推进”式运动(如李斯特菌),也不像衣原体那样借助囊泡运输系统,这种革兰阴性菌竟能直接在胞质中“搭便车”,利用宿主的微管网络实现定向迁移。然而二十余年来,细菌如何“无中生有”地建立与动力蛋白(dynein)机械的连接,始终是微生物学领域的未解之谜。
剑桥医学研究委员会分子生物学实验室的Giulia Manigrasso团队在《Nature Communications》发表的研究,首次揭开了这一精巧的分子劫持策略。研究人员发现O. tsutsugamushi表面的自转运蛋白ScaC如同“分子鱼钩”,特异性捕获宿主dynein的激活衔接子BICD1/2,通过独特的构象调控机制启动细菌的“微管高铁”运输系统。这项研究不仅填补了病原体运动机制的关键空白,更为干预感染进程提供了全新靶点。
研究团队运用多学科技术手段展开攻关:通过免疫共沉淀质谱锁定ScaC-BICD1/2互作;线粒体重定位实验验证ScaC诱导的dynein依赖性运输;体外重建实验结合单分子TIRF显微镜(全内反射荧光显微镜)定量分析复合体运动特性;基因编辑细胞模型证实BICD1/2在细菌感染中的必要性;冷冻电镜与交联质谱解析ScaC-BICD2相互作用界面。
ScaC结合激活衔接子BICD1和BICD2
线粒体重定位实验显示,将ScaC靶向线粒体表面可引发显著的核周聚集效应,其强度与组成型激活的BICD2N片段相当。通过siRNA敲降实验证实BICD2是主要效应分子,而BICD1在过表达时可功能补偿。
ScaC与BICD2的CC3结构域相互作用
SEC-MALS(尺寸排阻色谱-多角度光散射)测定显示ScaC与BICD2形成2:2化学计量复合体。截断实验锁定结合区域为BICD2的第三卷曲螺旋域(CC3),交联质谱进一步将ScaC结合位点精确定位于119-136残基。值得注意的是,ScaC能竞争性取代宿主天然配体RANBP2,但对RAB6结合影响较小,提示其进化出独特的结合界面。
ScaC激活BICD2启动动力蛋白运动
体外重构实验证实,ScaC可破坏BICD2N与BICD2C的自抑制性相互作用。单分子运动分析显示,ScaC使全长BICD2激活dynein-dynactin的效率提升3倍(1.22±0.12 vs 0.44±0.12事件/μm/分钟),且74.8%运动事件中ScaC与dynein共定位。
BICD1/2是细菌核周转运的必要条件
基因敲除实验显示,BICD2单敲除即显著削弱细菌向核周的聚集,而双敲除则完全阻断该过程。值得注意的是,这种运输缺陷并不影响体外培养条件下的细菌增殖,暗示核周定位可能在体内感染或应激条件下发挥更重要作用。
这项研究建立了完整的“病原体-宿主运输机器”互作模型:
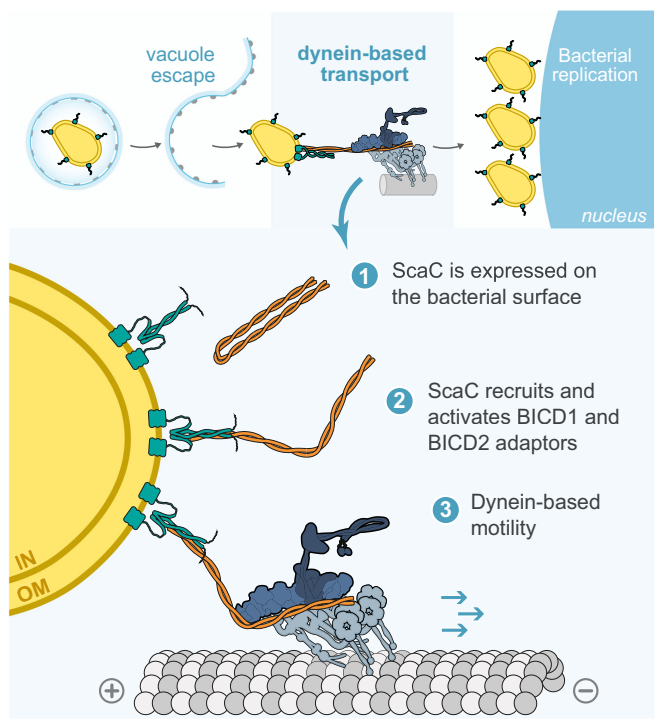
该研究遗留的悬念同样引人深思:为何细菌在体外无需核周定位仍能正常增殖?ScaC在感染后期的表达下调是否与细菌“出芽”式释放有关?这些问题的解答或将开启病原体时空调控宿主运输机器的新研究方向。正如研究者所言,ScaC-BICD2这一对“分子锁钥”不仅是微生物学的有趣案例,更将成为研究BICD衔接子生物学功能的独特工具。
 生物通微信公众号
生物通微信公众号
知名企业招聘