
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:室管膜细胞与神经干细胞是近亲
【字体: 大 中 小 】 时间:2025年07月04日 来源:Stem Cell Reports 5.9
编辑推荐:
这篇综述深入探讨了室管膜细胞(ECs)与神经干细胞(NSCs)的发育谱系关系,揭示了Geminin家族成员(GemC1/McIdas)通过调控转录和染色质组织协调这两种细胞命运的平衡。文章重点解析了多纤毛型(E1)与双纤毛型(E2)ECs的异质性特征,并探讨了双纤毛ECs在脊髓损伤修复中潜在的神经干细胞样功能,为开发针对脑积水(hydrocephalus)和神经退行性疾病的治疗策略提供了新视角。
在胚胎发育过程中,放射状胶质细胞(radial glial cells)被发现能双向分化为神经干细胞(NSCs)和室管膜细胞(ECs)。通过谱系追踪技术证实,这两种细胞在胚胎第14.5-16.5天(E14.5-E16.5)期间共享共同的祖细胞来源。Geminin蛋白家族在此过程中扮演关键调控角色:GemC1促进细胞周期退出并驱动ECs分化,而Geminin则通过对称分裂维持NSCs库的稳态。这种精确的平衡机制确保了脑室区(SVZ)生态位的正常功能。
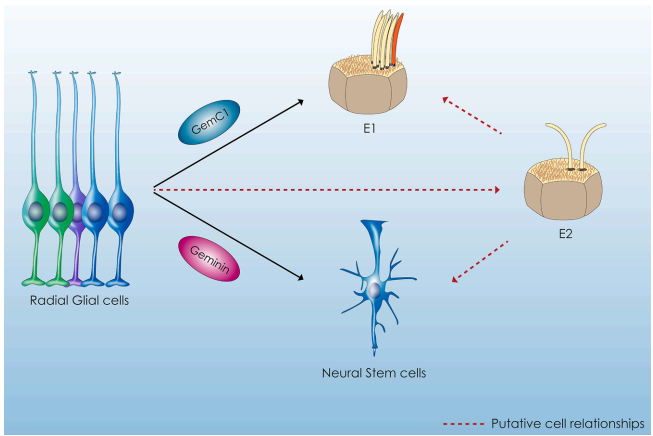
脑室区的ECs展现出显著的异质性。多纤毛ECs(E1)的顶膜分布着约50根运动纤毛(9+2微管结构),通过基底体的"从头合成"途径(deuterosome-dependent pathway)实现纤毛扩增。这些纤毛的协调摆动对脑脊液(CSF)循环至关重要,其功能缺陷与脑积水发生直接相关。而仅占5%的双纤毛ECs(E2)则具有独特的形态学特征:其两个正交排列的基底体呈马蹄形结构,纤毛被顶膜内陷形成的"纤毛袋"包裹,这种特殊构象提示其可能具有机械/化学传感功能。
脊髓中央管的研究为ECs的可塑性提供了重要线索。该区域的E2样细胞(Eccs)在损伤后可重编程获得神经干细胞特性,分化为少突胶质细胞和星形胶质细胞。单细胞转录组分析显示,Troy+亚群在损伤后表现出显著的转录重编程。这种现象引发了对脑部双纤毛ECs类似潜力的探讨——特别是在第三、第四脑室等神经内分泌调控关键区域,E2细胞可能通过Foxj1表达水平的动态调节参与稳态维持。
当前研究仍存在多个关键问题:不同脑区(如侧脑室与苍白球)的ECs是否具有区域特异性分化轨迹?双纤毛ECs能否通过调控Foxj1表达水平实现与多纤毛ECs的相互转化?最近的研究突破显示,星形胶质细胞可被重编程为功能性多纤毛ECs,这为开发基于ECs的脑积水治疗策略开辟了新途径。未来研究需进一步阐明E2细胞的分子特征及其在神经再生中的作用机制。
 生物通微信公众号
生物通微信公众号
知名企业招聘