
-

生物通官微
陪你抓住生命科技
跳动的脉搏
心外膜细胞通过双重调控心肌细胞增殖与电化学成熟促进心脏发育
【字体: 大 中 小 】 时间:2025年07月04日 来源:Stem Cell Reports 5.9
编辑推荐:
本研究针对hiPSC-CM(人诱导多能干细胞来源心肌细胞)成熟度不足的问题,通过构建2D/3D心外膜细胞(EPC)共培养模型,发现EPC能同时促进心肌细胞增殖和电化学成熟,而添加心外膜来源成纤维细胞(EPD-FB)可进一步实现机械成熟。该研究为心脏再生医学提供了模拟胚胎发育的新策略,发表于《Stem Cell Reports》。
在心脏再生医学领域,如何获得功能成熟的心肌细胞一直是重大挑战。虽然hiPSC-CM(人诱导多能干细胞来源心肌细胞)技术已发展十余年,但这些细胞仍保持着胎儿般的特征:圆润的形态、紊乱的肌节结构、依赖糖酵解供能,以及缺乏成熟的钙离子处理能力。更令人困扰的是,传统认为心肌细胞增殖与成熟存在"鱼与熊掌不可兼得"的矛盾——成熟往往伴随增殖能力的丧失。这种困境促使科学家将目光转向胚胎发育过程,试图从自然发育规律中寻找突破口。
明尼苏达大学的研究团队在《Stem Cell Reports》发表的研究给出了创新性答案。通过系统分析小鼠胚胎发育过程,研究人员发现即使在心肌细胞高增殖期(E10达75%),肌节长度和细胞面积仍在持续增加。这一反直觉的现象暗示:在天然发育过程中,心肌细胞的某些成熟特征确实可以与增殖并存。受此启发,研究团队构建了hiPSC-CM与心外膜细胞(EPC)的共培养体系,发现EPC不仅能促进心肌细胞增殖(2D培养中增殖率从20%提升至27%),还显著改善了电生理功能——钙瞬变(Ca2+ transient)峰值时间缩短,动作电位(AP)最大上升速率(Vmax)翻倍。单细胞测序揭示这种"双赢"效果可能与WNT信号通路上调有关。
关键技术包括:hiPSC定向分化为心肌细胞和心外膜细胞、2D/3D共培养系统构建、钙成像和膜片钳电生理记录、单细胞RNA测序(scRNA-seq)、牵引力显微镜(TFM)以及工程化心脏组织(EHT)力学测试。研究使用来自3个hiPSC细胞系(M4、F7和CCND2)的细胞确保结果可重复性。
研究结果部分:

心外膜共培养组成:建立hiPSC-CM与EPC的2D共培养体系,通过TGF-β抑制剂(SB431542)控制EPC上皮-间质转化(EMT),形成含67% cTnT+ CM的混合培养物。
心外膜细胞增强CM增殖:EPC使CM增殖标志物EdU+细胞比例显著增加,且该效应具有细胞系依赖性,CCND2系因EPC保留量低而效果较弱。
功能成熟提升:EPC共培养使Ca2+瞬变峰值时间缩短40%,动作电位时程(APD90)达800ms,接近成人心室肌细胞特征。
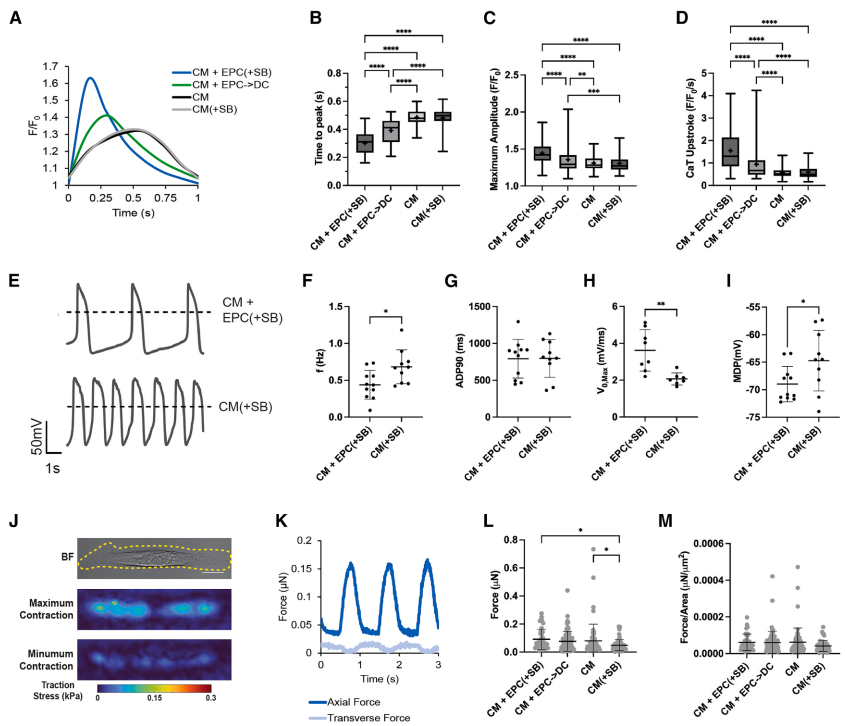
形态学成熟:EPC(+SB)组肌节长度达1.94μm,线粒体与肌节并列排列,但成熟肌节M线仍缺失,呈现"电成熟先于机械成熟"的特点。
单细胞转录组特征:vCMEPC(+SB)_bulk群体高表达RYR2、ATP2A2等电传导基因,但肌节蛋白仍以胎儿型为主,符合"中间态"发育特征。
3D心脏组织验证:在EHT模型中,EPC衍生物维持电生理改善(传导速度提升),但仅当添加EPD-FB后,组织收缩力才实现量级提升(0.01→0.1mN)。
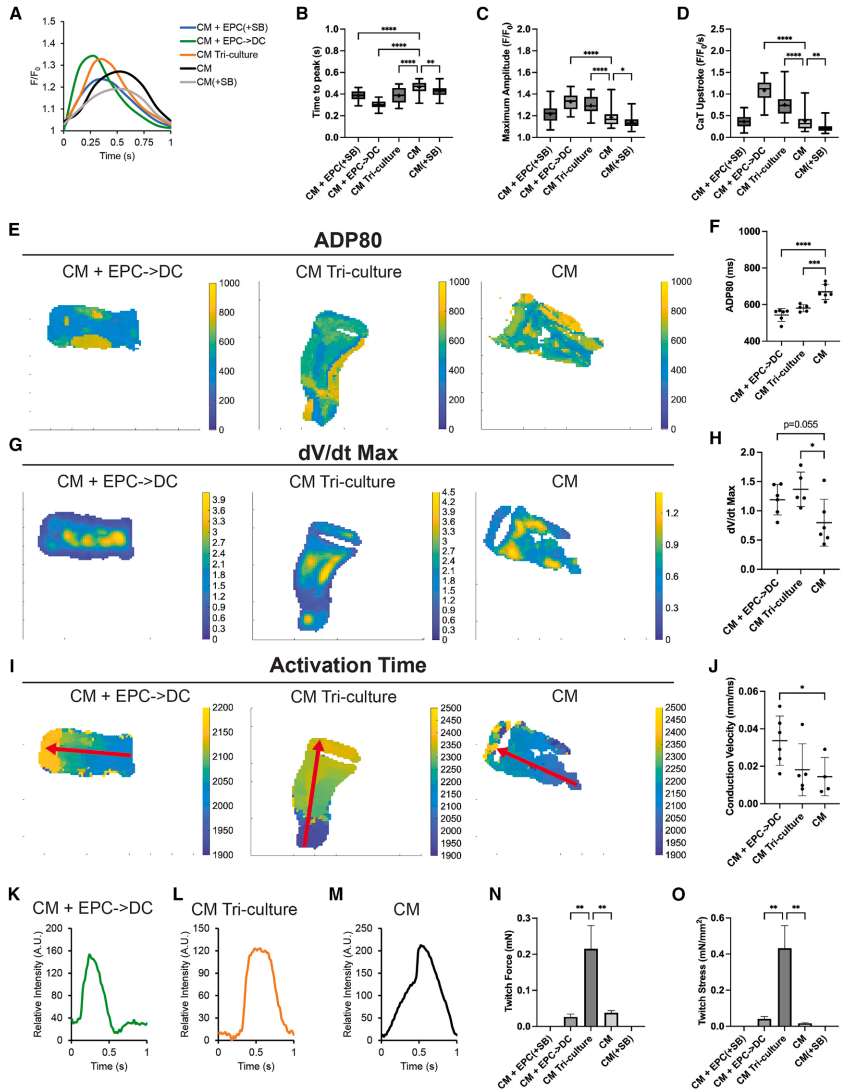
这项研究打破了心肌细胞增殖与成熟不可兼得的传统认知,揭示胚胎发育过程中存在关键的"中间态"——心外膜信号可同时激活CM增殖和电化学成熟,而成纤维细胞的加入则推动后续机械成熟。这种分阶段模拟发育的策略(先胚胎期EPC信号,后胎儿期基质信号)为hiPSC-CM体外成熟提供了新范式。从转化医学角度看,该发现不仅对心脏组织工程有重要意义,也为理解先天性心脏病中心外膜缺陷导致的室壁发育异常提供了分子线索。未来研究可探索WNT5A等关键介质能否替代EPC产生类似效果,以及将这种阶段化成熟策略与现有机械拉伸、电刺激等方法联用,进一步逼近成人心肌细胞表型。
 生物通微信公众号
生物通微信公众号
知名企业招聘