
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:AI与物理学在基于结构的GPCR药物发现中的交汇
【字体: 大 中 小 】 时间:2025年07月04日 来源:npj Drug Discovery
编辑推荐:
这篇综述系统探讨了人工智能(AI)与物理学方法在G蛋白偶联受体(GPCR)结构预测与药物发现中的协同应用。文章详细分析了AlphaFold2(AF2)等AI工具在GPCR三维结构预测中的突破性进展,同时指出其局限性(如构象状态单一性),并提出了结合诱导契合对接(IFD)和自由能微扰(FEP)等物理方法的优化策略。通过GPCR Dock社区评估案例,论证了AI模型在虚拟筛选(VLS)和先导化合物优化中的实际应用价值,为计算药物发现提供了多模态融合的新范式。
AI驱动的GPCR结构预测革命
G蛋白偶联受体(GPCR)作为最重要的药物靶点家族,其结构解析长期面临技术瓶颈。AlphaFold2(AF2)的出现彻底改变了这一局面——截至2025年3月,AF2已为全部800余种GPCR构建了预测模型,其中Class A亚家族674个受体的跨膜(TM)结构域预测置信度(pLDDT>90)接近实验精度。值得注意的是,AF2对配体结合口袋的预测准确性尤为突出,TM区正构口袋的侧链重原子RMSD普遍小于2?。

然而这些AI模型仍存在明显局限:无法自主区分受体激活状态(如AF2倾向于生成"平均构象"),且胞外环(ECL)与TM域组装精度不足。为解决此问题,Feig团队开发的AlphaFold-MultiState通过引入状态特异性模板数据库,成功生成了与实验结构高度吻合的活性/非活性状态模型。
GPCR-配体复合物预测的突破与挑战
配体结合模式的准确预测是药物设计的核心环节。2021年GPCR Dock评估显示,对于小分子配体(如GPR139-JNJ-63533054复合物),传统对接方法的预测精度(配体RMSD<2.5?)与AF2模型相当;但对肽类配体(如神经肽Y受体-NPY复合物),AlphaFold-Multimer通过共折叠策略将预测精度提升至前所未有的水平。

最新发展的DiffusionProteinLigand、AlphaFold3(AF3)等扩散模型虽能实现小分子-受体复合物的端到端预测,但仍面临物理合理性不足的问题——约25%的预测存在键长/键角违规或立体化学错误。相比之下,结合分子动力学(MD)的诱导契合对接(IFD-MD)方法在保持物理有效性的同时,对结合口袋局部重构的模拟更为可靠。
虚拟筛选中的模型选择策略
在基于结构的虚拟筛选(VLS)应用中,AF2模型的性能呈现显著靶点依赖性。5-HT2A受体案例显示,未经优化的AF2模型虽在回顾性测试中表现不佳,却能前瞻性发现与晶体结构筛选结果相当的新骨架配体(命中率~60%)。关键发现在于:模型几何精度与VLS性能并非简单线性相关,通过受体特异性解耦剂(decoy)集验证和多模型集成策略可显著提高预测可靠性。
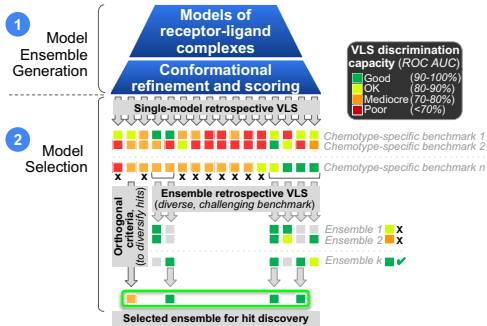
值得注意的是,AI加速的超大规模库筛选(如MolPAL、GigaScreen平台)通过神经网络打分函数外推,已实现百亿级化合物库的高效探索,在D4多巴胺受体等靶点中展现出巨大潜力。
自由能微扰指导的先导化合物优化
在hit-to-lead(H2L)优化阶段,相对结合自由能微扰(RB-FEP)对模型精度要求严苛。多巴胺D3受体研究表明,即使配体RMSD仅1.2?的模型,其RB-FEP预测误差(RMSE=2.8 kcal/mol)仍显著高于实验结构。而生长抑素SST4受体案例证明,经IFD-MD优化的AF2模型对64个类似物的活性预测(R2=0.54)已达到指导化合物优化的实用水平。

绝对结合自由能(AB-FEP)计算可作为模型验证的补充工具——当多个模型RB-FEP性能相近时,AB-FEP能识别出ΔGbinding预测显著偏离实验值的"假阳性"模型。关键启示在于:ICL区构象、结合位点水分子排布等细微结构特征,对FEP预测精度的影响可能远超全局RMSD指标。
 生物通微信公众号
生物通微信公众号
知名企业招聘