
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:二氢大豆苷元的资源、生物合成途径、生物利用度及生物活性研究进展
【字体: 大 中 小 】 时间:2025年07月05日 来源:Phytochemistry Reviews 7.3
编辑推荐:
这篇综述系统总结了二氢大豆苷元(DHD)的资源分布、理化性质、体内代谢途径(涉及肠道微生物群介导的生物转化)、生物利用度(如纳米载体技术提升策略)及其多重生物活性(抗氧化、心血管保护、抗骨质疏松等)。重点阐述了DHD作为大豆异黄酮(SIF)关键代谢产物的优势:较前体大豆苷元(DAI)具有更高水溶性(0.14 g/L vs 0.085 g/L)和更广谱药理活性,其合成依赖特定菌株(如Slackia isoflavoniconvertens DSM22006)及dzr/ddr/tdr基因簇编码的还原酶体系。
二氢大豆苷元(DHD)作为大豆异黄酮(SIF)的重要代谢产物,在自然界中无法直接从植物中获取,主要通过微生物发酵、化学合成和酶催化三种途径制备。其中微生物发酵是最具前景的方法,代表性菌株包括Aeroto-Niu-O16、TM-40等,这些菌株携带dzr/ddr/tdr基因簇,可高效将大豆苷元(DAI)转化为DHD。化学合成路线则以DAI为底物,通过PCC氧化剂选择性催化获得目标产物,摩尔收率可达较高水平。

肠道微生物在DHD代谢中扮演核心角色,其转化过程涉及多步反应:DAI首先被还原为DHD,进而通过开环或去酮基反应生成活性更高的雌马酚(EQ)。关键酶包括DAI还原酶(DZNR)、DHD还原酶(DHDR)和四氢大豆苷元还原酶(THDR),这些酶依赖NADH辅因子发挥作用。值得注意的是,Slackia isoflavoniconvertens DSM22006菌株中发现的ddr基因编码的短链脱氢酶(SDR),与DHD的立体选择性转化密切相关。

尽管DHD水溶性优于DAI,但其口服生物利用度仍受限于酚羟基结构。最新研究显示,纳米载体技术(如TPGS乳化玉米蛋白纳米粒)可将DHD的Cmax提升2.64倍。Caco-2细胞模型证实,DHD在pH 6/7.4条件下的有效渗透性(0.48×10-6 cm/s)显著高于DAI,这与其主动转运机制相关。
抗氧化:DHD通过清除自由基和激活抗氧化酶(如超氧化物歧化酶)发挥效应,其7位酚羟基的p-π共轭效应是关键作用位点。在DPPH自由基清除实验中,DHD活性虽不及EQ,但显著优于DAI。
抗癌:结构类似17β-雌二醇的DHD能竞争性结合雌激素受体,抑制血管内皮生长因子(VEGF)表达,从而阻断肿瘤血管生成。临床数据显示,高水平DHD代谢人群的前列腺癌风险降低。
心血管保护:DHD通过调节载脂蛋白AI/B100平衡,降低低密度脂蛋白(LDL)氧化,其效果呈剂量依赖性:EQ > THD > DHD > DAI。
抗骨质疏松:动物实验表明,含DHD的发酵大豆能使骨密度提升18%,其机制涉及Bmp-2信号通路上调(图6A)。MC3T3-E1细胞中,DHD通过抑制NF-κB配体(RANKL)减少破骨细胞分化。
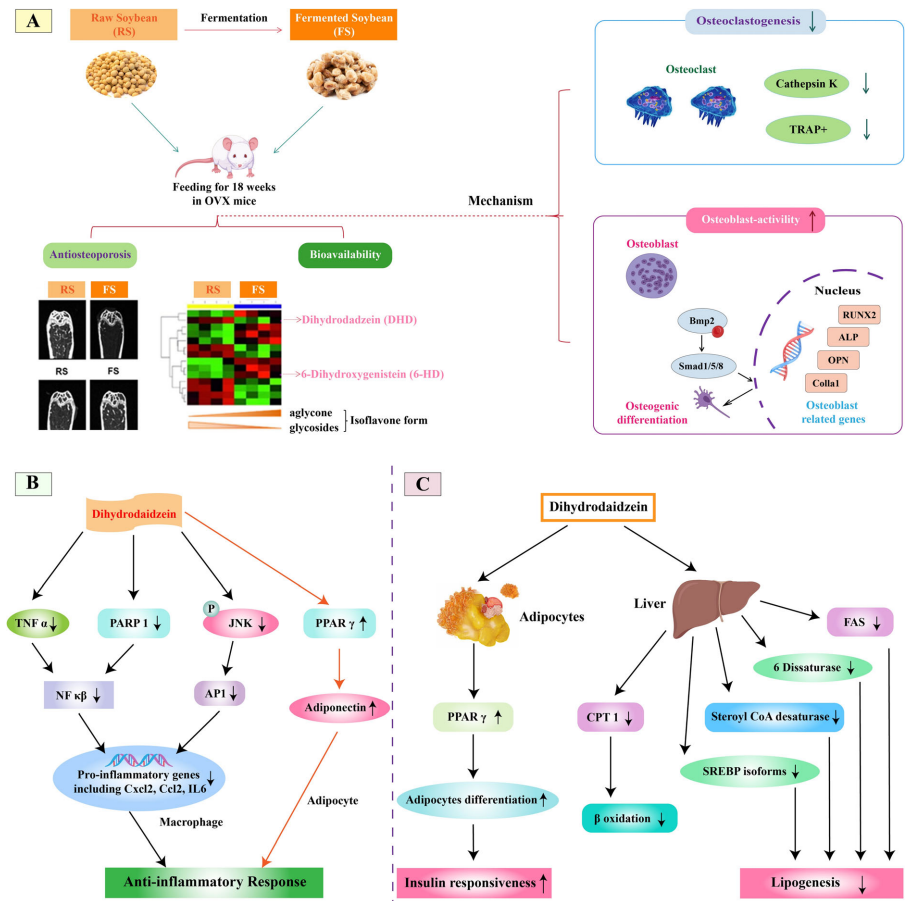
当前挑战在于提高DHD单产物转化效率,未来可通过宏基因组学解析微生物代谢网络,或构建基因工程菌株优化dzr/ddr酶系。作为功能性食品添加剂,DHD与益生菌联用可能成为预防雌激素相关疾病的新策略。
 生物通微信公众号
生物通微信公众号
知名企业招聘