
-

生物通官微
陪你抓住生命科技
跳动的脉搏
细菌中单亚基寡糖转移酶DmPgIB的发现实现全长IgG抗体的糖基化修饰
【字体: 大 中 小 】 时间:2025年07月05日 来源:Nature Communications 14.7
编辑推荐:
研究人员针对细菌中无法高效糖基化人类IgG抗体Fc区天然QYNST位点的难题,通过基因组挖掘发现Desulfovibrio marinus来源的单亚基寡糖转移酶DmPgIB,其松弛的底物特异性可实现30-50%的糖基化效率,经化学酶法修饰后产生的G2糖型能特异性结合FcyRIIIa受体,为细菌生产全人源化抗体奠定基础。
糖基化修饰是影响抗体药物功能的关键因素,但传统哺乳动物表达系统存在成本高、糖型不均一等瓶颈。尽管大肠杆菌(Escherichia coli)表达系统具有成本优势,但其缺乏糖基化能力,尤其是无法在IgG抗体保守的N297位点(QYNST序列)实现高效N-糖基化。既往研究虽尝试改造细菌糖基化系统,但受限于寡糖转移酶(OST)的严格底物特异性,糖基化效率不足5%,且仅能修饰突变的Fc序列。
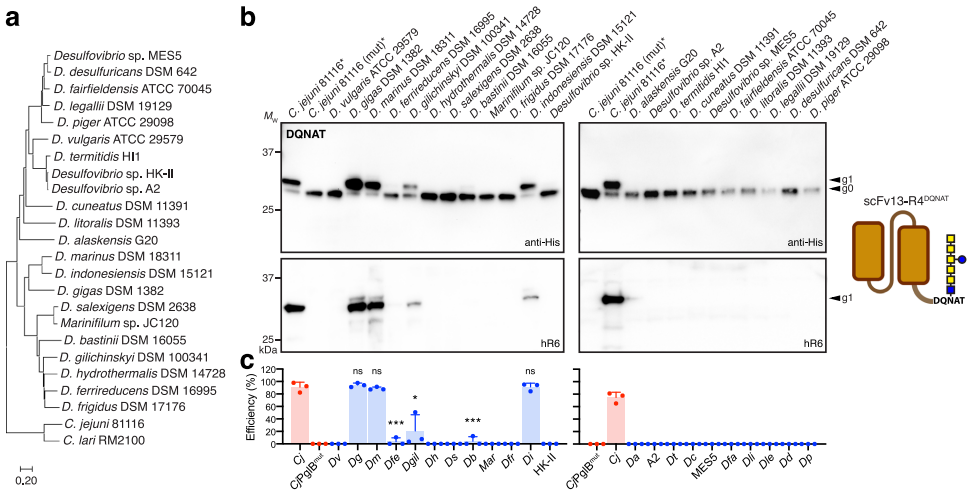
为解决这一难题,康奈尔大学等机构的研究团队通过生物勘探策略,从19种Desulfovibrio菌株中筛选出D. marinus来源的单亚基OST——DmPgIB。该酶突破性地实现了对天然QYNST位点的高效修饰,相关成果发表于《Nature Communications》。
研究采用三项关键技术:1) 建立跨物种互补实验系统,通过共表达糖链合成基因(pglABCDEF)和候选OST基因进行功能筛选;2) 开发glycoSNAP高通量筛选平台,系统分析DmPgIB对20种氨基酸的-2位点偏好性;3) 结合LC-MS/MS糖蛋白组学验证糖基化位点,并通过化学酶法将细菌型GalNAc5GlcNAc糖链重塑为真核生物G2(Gal2GlcNAc2Man3GlcNAc2)糖型。
主要研究结果
DmPgIB展现广谱底物特异性
通过scFv13-R4模型蛋白证实DmPgIB可高效修饰含DQNAT(91%)、AQNAT(90%)和QYNST(95%)等非经典序列,其催化效率(kcat=0.24-0.33 h-1)与天然CjPgIB相当,但对QYNST的KM(5.16 μM)显著低于CjPgIB(10.7 μM)。结构模型显示其肽结合腔入口呈电中性,与真核STT3更相似。
实现天然Fc结构域糖基化
在完整IgG1(YMF10)中,DmPgIB使重链(HC)糖基化效率达10-14%,较DgPgIB(<2%)提升5倍以上。质谱明确检测到293EEQYNSTYR301肽段的HexNAc6Hex1修饰,证实天然位点修饰。
糖链重塑恢复效应功能
通过α-半乳糖苷酶和糖苷合成酶EndoS2-D184M将细菌糖链转化为G2糖型,ELISA显示G2-Fc与FcyRIIIA-V158结合活性(EC50=28.5 nM)接近临床抗体曲妥珠单抗(5.4 nM)。
该研究不仅阐明细菌OST的进化适应性机制,更建立细菌-化学酶法联用平台,首次实现细菌表达系统生产具有天然效应功能的IgG。DmPgIB的发现为抗体糖型精准调控提供新工具,对发展低成本、均一化抗体药物具有重要意义。
 生物通微信公众号
生物通微信公众号
知名企业招聘