
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:mRNA疫苗和靶向癌症免疫治疗的小干扰RNA:挑战与机遇
【字体: 大 中 小 】 时间:2025年07月06日 来源:Discover Oncology 2.8
编辑推荐:
这篇综述系统阐述了RNA技术在癌症免疫治疗中的突破性进展,重点探讨了mRNA疫苗编码肿瘤特异性抗原(TSA)和siRNA沉默致癌基因的双重策略。文章剖析了脂质纳米颗粒(LNP)递送系统优化、RNA化学修饰(如m6A和假尿苷)提升稳定性等关键技术突破,同时指出免疫相关不良事件(如CRS)和靶向递送效率仍是临床转化的核心挑战。
癌症免疫治疗领域正经历着RNA技术带来的范式变革。基于信使RNA(mRNA)和小干扰RNA(siRNA)的疗法通过截然不同的机制——前者编码抗原激活免疫应答,后者沉默致癌基因——共同构成了精准打击肿瘤的"基因导弹"。2020年COVID-19 mRNA疫苗的成功更验证了该技术的临床转化潜力,为肿瘤治疗开辟了新战场。
mRNA疫苗的核心优势在于其"生物打印机"特性:通过脂质纳米颗粒(LNP)递送的合成mRNA能在宿主细胞内直接翻译成肿瘤特异性抗原(如新抗原),经MHC分子呈递后激活细胞毒性T细胞(CTL)和CD4+辅助T细胞的协同反应。如图1所示,LNP-mRNA复合物通过局部注射后,突破生理屏障实现胞质递送,其设计灵活性允许快速开发针对个体化突变谱的多价疫苗。

临床转化方面,目前已有10余项mRNA肿瘤疫苗进入试验阶段(表1)。例如NCT05949775研究将新抗原mRNA疫苗与信迪利单抗联用,针对晚期实体瘤展现个性化治疗潜力。值得注意的是,mRNA-1273疫苗(原用于COVID-19)在NCT04847050试验中与PD-1抑制剂联用,探索了"传染病疫苗抗癌"的跨界应用。
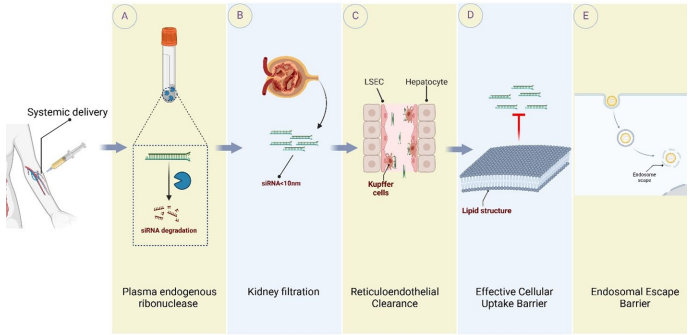
siRNA则扮演着"基因剪刀"角色,通过RNA干扰(RNAi)机制精准降解致癌基因mRNA。如图2所示,系统递送的siRNA需突破血浆核糖核酸酶降解、肾脏过滤等多重生物屏障,最终通过RISC复合物介导靶标mRNA切割。目前针对PLK1、BCL2等关键靶点的siRNA药物(如TKM-080301)已在肝癌、淋巴瘤等适应症中开展临床试验。
RNA疗法面临的最大挑战是递送效率与稳定性。病毒载体(如AAV)虽转染效率高,但存在插入突变风险;非病毒系统如阳离子聚合物则面临剂量毒性。创新性解决方案包括:
RNA免疫治疗的终极目标是实现"癌症疫苗工厂"愿景:通过快速测序→新抗原预测→mRNA合成→LNP封装的全流程自动化,72小时内完成个体化制剂生产。与CRISPR、免疫检查点抑制剂等技术的联用,或将催生"基因免疫鸡尾酒疗法"。但需警惕肝毒性(如GalNAc-siRNA的脱靶效应)和细胞因子风暴等风险,这要求我们在RNA化学修饰(如锁核酸LNA引入)与递送精度间寻求最佳平衡。
 生物通微信公众号
生物通微信公众号
知名企业招聘