
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:内源性逆转录病毒HERVH在人类早期胚胎发生中的驯化:变得有用且不被察觉
【字体: 大 中 小 】 时间:2025年07月06日 来源:Mobile DNA 4.7
编辑推荐:
这篇综述深入探讨了内源性逆转录病毒HERVH在人类早期胚胎发育中的独特驯化机制。文章创新性地提出"非必要转录本假说",揭示HERVH通过竞争性结合KLF4转录因子、形成嵌合转录本等策略,成功逃逸宿主细胞的多种抑制系统(如TRIM28/KAP1复合物),最终被招募参与多能性维持(PSCs)、自我更新和转座子防御等重要生物学过程。研究为理解转座元件(TEs)驯化提供了新视角,对基因治疗载体设计和肿瘤功能获得机制具有重要启示。
内源性逆转录病毒的进化奇遇
在基因组演化的长河中,内源性逆转录病毒(ERVs)如同被驯化的野马,从曾经的基因组入侵者转变为重要的功能元件。LTR7-HERVH作为灵长类特有的ERV家族,在人类早期胚胎发育中展现出惊人的功能可塑性,其驯化过程堪称分子进化的典范。
基因组防御与功能驯化的博弈
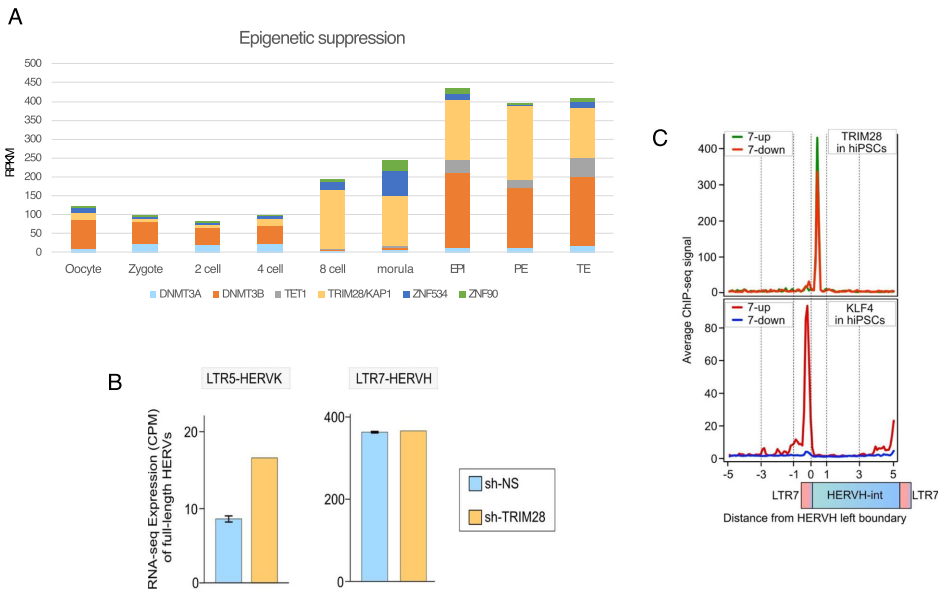
传统观点认为,转座元件(TEs)的驯化主要依赖其固有的功能 predisposition,如转录因子结合位点或功能性产物。然而最新研究发现,HERVH的成功驯化更关键的是其逃逸宿主防御系统的能力。人类细胞进化出了多层次的"非必要转录本"过滤机制,包括表观遗传沉默(H3K9me3)、核降解(RNA exosome)和核输出控制等。令人惊讶的是,在某些人类多能干细胞(hPSCs)中,HERVH衍生的转录本竟占总转录本的2%,这种高表达水平挑战了传统认知。
分子伪装大师的生存策略
HERVH逃逸宿主防御的策略堪称精妙:

多能性舞台上的核心演员
HERVH在人类胚胎发育中扮演着多重角色:
发育时序的精确调控
HERVH的表达呈现严格的时空特异性:
医学转化的双重启示
对基因治疗的启示:
对肿瘤研究的启示:
进化生物学的范式转变
HERVH的研究颠覆了传统认知:
未来研究将深入探索HERVH在不同细胞环境中的动态调控,以及其在再生医学和精准治疗中的潜在应用。这场持续4000万年的分子共舞,仍在继续书写新的进化篇章。
 生物通微信公众号
生物通微信公众号
知名企业招聘