
-

生物通官微
陪你抓住生命科技
跳动的脉搏
PARP抑制剂奥拉帕尼通过诱导DNA损伤增强犬造血系统癌症化疗敏感性:机制研究与精准医疗启示
【字体: 大 中 小 】 时间:2025年07月06日 来源:BMC Veterinary Research 2.3
编辑推荐:
本研究针对犬类淋巴瘤/白血病靶向治疗空白,首次在体外模型中系统评估PARP抑制剂olaparib单药及联合阿霉素的疗效。发现olaparib通过抑制代谢活性、降低Ki-67增殖标志、诱导γH2A.X介导的DNA损伤发挥单药活性,并通过协同指数(CI<1)证实其增敏阿霉素作用。RNA-seq揭示CLBL-1(高敏感)与GL-1(低敏感)细胞系在TP53、BRCA1/2等DNA损伤修复基因的突变差异,为兽医精准医疗提供分子依据,推动PARPis在犬类癌症的临床转化。
在兽医肿瘤学领域,随着犬类癌症基因检测技术(如NGS)的普及,越来越多DNA损伤修复通路(如同源重组修复/HR)缺陷的肿瘤被识别。然而,针对这类疾病的靶向治疗研究严重滞后。PARP抑制剂(PARPis)在人类癌症(尤其是BRCA1/2突变肿瘤)中通过"合成致死"机制已取得显著疗效,但其在犬类癌症的应用仍缺乏系统性研究。犬类淋巴瘤和白血病作为高发造血系统恶性肿瘤,传统化疗方案存在心脏毒性(如阿霉素累积剂量限制)和耐药问题。因此,探索PARPis在犬类模型中的疗效机制,对开发口服靶向药物、优化联合化疗策略具有迫切需求。
波兰弗罗茨瓦夫环境与生命科学大学联合意大利帕多瓦大学的研究团队,选取四种犬源癌细胞系(B细胞淋巴瘤CLBL-1、NK细胞淋巴瘤CNK-89、B细胞白血病GL-1、慢性淋巴细胞白血病CLB70),通过以下关键技术展开研究:
通过MTT实验证实,olaparib以浓度和时间依赖性方式显著抑制所有细胞系的代谢活性(图1)。72小时IC50值显示:CLBL-1(2.68μM)、CLB70(3.03μM)、CNK-89(2.03μM)高度敏感,而GL-1敏感性较低(6.83μM)。Ki-67流式检测进一步验证其抗增殖作用,50μM olaparib处理48小时后,CLBL-1增殖细胞比例降至13%(图2)。


Western blot结果显示,olaparib处理后24小时即可诱导γH2A.X显著表达(图3),证明其通过阻断PARP介导的DNA单链断裂修复,导致损伤累积。值得注意的是,低敏感性细胞GL-1也出现DNA损伤,提示其耐药性可能源于补偿性修复机制。

预孵育olaparib 48小时后联用阿霉素,显著增强细胞毒性(图4A)。联合指数(CI)分析显示:在CLBL-1细胞中多数组合呈中度协同(CI=0.3–0.7),GL-1细胞在高浓度时亦达协同效应(CI<1)(图4B)。例如,olaparib (5μM) + 阿霉素(50nM)使CLBL-1细胞活性降低>70%,为降低阿霉素剂量、减轻心脏毒性提供依据。
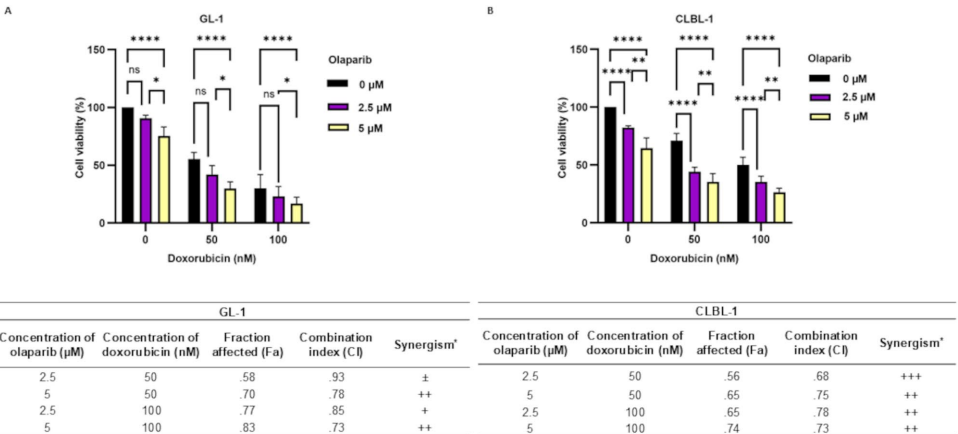
RNA-seq分析发现:高敏感细胞CLBL-1携带TP53双重杂合突变(c.374C>T/c.764G>A)和BRCA2致病性变异(c.2401A>C);而低敏感细胞GL-1存在TP53纯合突变(c.709C>T)和BRCA1致病突变(c.1329A>C)。二者共享ATM(c.3431A>T)和ATR(c.1550_1561del)变异,但CLBL-1的ATR(c.539G>A)致病性突变可能削弱其DNA损伤修复能力,增加olaparib敏感性(表2)。
本研究首次在犬类造血系统癌症模型中系统阐明olaparib的双重作用机制:作为单药通过诱导DNA损伤和抑制增殖发挥疗效;作为化疗增敏剂通过抑制修复通路增强阿霉素的细胞毒性。突变谱分析将TP53/BRCA1/2变异与药物敏感性关联,为犬类癌症的精准医疗提供分子分型依据(如携带HR通路缺陷的犬类适用PARPis)。其重要意义在于:

 生物通微信公众号
生物通微信公众号
知名企业招聘