
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:心磷脂在神经元缺血/再灌注损伤中线粒体动力学和质量控制中的作用
【字体: 大 中 小 】 时间:2025年07月06日 来源:Cell Death & Disease 8.1
编辑推荐:
这篇综述深入探讨了心磷脂(CL)在神经元缺血/再灌注(I/R)损伤中对线粒体动力学(分裂/融合)和质量控制(如线粒体自噬)的调控机制。文章系统阐述了CL通过稳定电子传递链(ETC)复合体、调节Drp1介导的分裂及Opa1依赖的融合,并参与PINK1/Parkin和CL依赖性线粒体自噬通路,最终影响神经元存活。其研究为I/R损伤(如卒中、心脏骤停)的干预策略提供了新靶点。
心磷脂(CL)是线粒体内膜(IMM)特有的磷脂,由甘油骨架和四个酰基链构成,其分子不对称性和跨膜分布特性对维持线粒体功能至关重要。CL通过稳定ETC复合体III和IV支持细胞呼吸,并与细胞色素c结合调控凋亡。CL生物合成始于磷脂酸(PA)转化为CDP-DAG,经PGS1和PTPMT1催化生成磷脂酰甘油(PG),最终由CRLS1合成未成熟CL。随后,Tafazzin(TAZ)介导的酰基链重塑将未成熟CL转化为富含不饱和脂肪酸的成熟CL。若TAZ功能异常,中间产物单溶血心磷脂(MLCL)积累可破坏膜电位,导致线粒体功能障碍。

线粒体通过分裂和融合维持网络稳态。分裂由Drp1执行,其通过磷酸化(如CaMK1α介导的S600磷酸化)招募至线粒体外膜(OMM),与受体Mff(基础分裂)或Fis1(应激诱导分裂)相互作用形成寡聚环,在ER tubules辅助下完成膜裂变。CL通过结合Drp1的保守基序促进GTP水解,增强分裂效率。
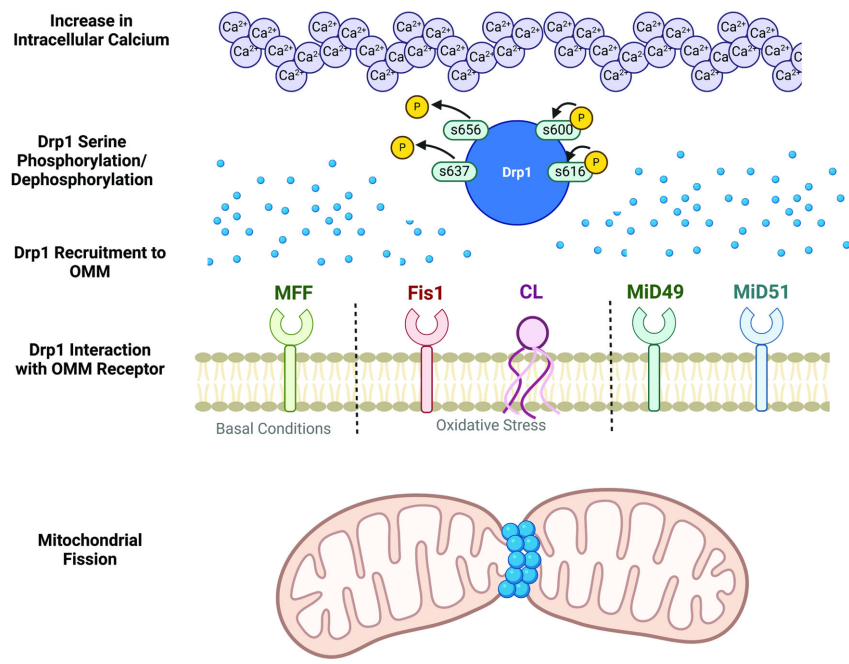
融合则由Mfn1/2(OMM)和Opa1(IMM)介导。GTP激活的Mfn1/2形成寡聚体桥接相邻线粒体,而L-Opa1通过结合对侧膜CL触发GTP依赖性内膜融合。S-Opa1则主要维持嵴结构。

神经元I/R引发两波分裂:缺血期因ROS和钙超载导致Drp1激活,再灌注后期因能量衰竭和mPTP开放再次触发分裂。Opa1过度切割(如Oma1介导)加剧碎片化,而Mfn2过表达或Drp1抑制可挽救线粒体网络并改善细胞存活。
PINK1/Parkin通路是经典线粒体自噬机制。线粒体去极化时,PINK1积累于OMM,磷酸化泛素和Parkin(S65),招募OPTN/p62等适配体启动自噬。

CL依赖性线粒体自噬则由PLS3将CL外翻至OMM,直接被LC3识别,或通过结合Beclin 1诱导自噬。

分裂隔离损伤线粒体以促进其自噬清除,而Mfn2泛素化既可抑制融合又可增强Parkin招募。CL通过调节PINK1稳定性和ETC功能间接影响Parkin通路,凸显其核心地位。
心磷脂作为线粒体膜的核心组分,通过调控动力学蛋白(Drp1/Opa1)和自噬信号(PINK1/LC3),在I/R损伤中扮演“分子开关”角色。未来研究需进一步解析CL亚型特异性功能,为卒中治疗提供精准靶点。
 生物通微信公众号
生物通微信公众号
知名企业招聘