
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:理解去中心化临床试验(DCTs)预期与现实之间的差距
【字体: 大 中 小 】 时间:2025年07月07日 来源:npj Digital Medicine 12.4
编辑推荐:
(编辑推荐)这篇综述系统剖析了去中心化临床试验(DCTs)的发展困境:尽管COVID-19疫情期间DCTs应用激增,但后疫情时代其使用率骤降,78.2%的试验仅采用单一远程元素(如远程数据收集占91.9%),且未显著提升试验完成率(82.4% vs 传统83.3%)。研究指出DCTs在肿瘤领域渗透率仅0.18%,核心矛盾在于技术成熟度不足、跨区域监管壁垒及成本效益未达预期,亟需风险分级管理策略推动其成为新范式。
过去十年间,去中心化临床试验(Decentralized Clinical Trials, DCTs)被FDA定义为通过电子知情同意(eConsent)、可穿戴设备等非传统方式执行的临床研究。2011年辉瑞REMOTE试验首次实现全虚拟模式,但直到COVID-19疫情期间才迎来爆发式增长——2020-2021年DCTs数量激增50%,随后却快速回落至疫情前水平。
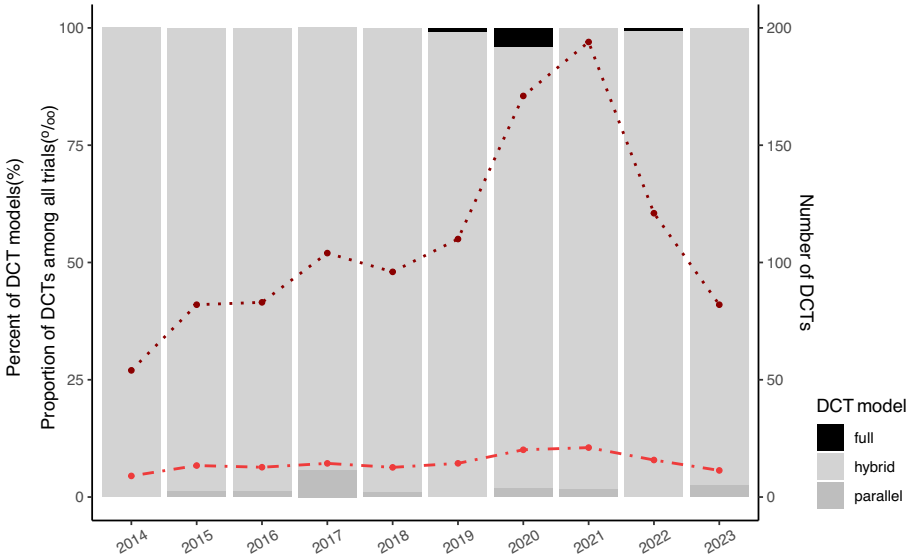
分析1097项DCTs显示,远程数据收集(91.9%)占据主导,而关键环节如远程招募(4.1%)和直达患者(DTP)药物配送(7.1%)应用极少。值得注意的是,97.6%为混合模式,仅8项实现全远程——其中4项针对COVID-19。这种碎片化应用导致78.3%的DCTs仅整合单一元素,难以实现预期的成本节约。
对比86.9万项传统试验发现,DCTs既未提高完成率(82.4% vs 83.3%),也未降低终止风险(5.8% vs 5.3%)。地域分布极不均衡:美国占61.3%,非洲仅9.1%。呼吸系统疾病(13.6%)和神经系统疾病(13.3%)是主要适应症,但肿瘤试验中DCTs渗透率不足0.2%,凸显技术适用场景的局限性。

研究者建议从三方面破局:
当前DCTs仍处于"工具组合"阶段,其真正转型需要监管机构、技术服务商和申办方的协同创新,特别是在多区域临床试验(MRCTs)中验证全模式可行性。随着ICH E6(R3)等新规出台,数据跨境管理标准的确立将成为下一阶段发展关键。
 生物通微信公众号
生物通微信公众号
知名企业招聘