
-

生物通官微
陪你抓住生命科技
跳动的脉搏
肠道菌群介导的脂质积累驱动果蝇蓝光毒性进化适应:中肠延长的关键作用
【字体: 大 中 小 】 时间:2025年07月08日 来源:Communications Biology 5.2
编辑推荐:
面对农业害虫对化学农药的快速进化抵抗,蓝光(BL)作为替代性防控手段存在耐受性演化风险。日本冈山大学团队通过70代果蝇实验室选择实验,发现BL耐受品系(SL)通过中肠延长促进肠道微生物(Acetobacter persici)增殖,进而驱动宿主脂质积累(TAG升高),形成“适应性肥胖”以抵抗BL诱导的氧化损伤。该研究揭示了宿主-微生物互作在环境胁迫适应中的核心机制,为害虫防控策略设计提供新思路。
农业害虫防控长期面临化学农药诱导的耐药性进化挑战,亟需开发环境友好型替代方案。蓝光(Blue Light, BL)因其对多种昆虫的致死效应(如果蝇、蚊子)成为新兴物理防控手段,但其作用机制及昆虫的进化响应尚不明确。尤其值得关注的是,BL暴露可显著抑制雌性昆虫卵巢发育(补充图2),即使短暂照射也会造成生殖能力的持续性损伤,这为理解其作为选择压力的生态影响提供了关键线索。
为解析昆虫对BL的适应机制,日本冈山大学、德国神经退行性疾病中心等机构的研究团队以黑腹果蝇(Drosophila melanogaster)为模型,开展长达70代(约3年)的实验室选择实验。研究者从近交系Canton-S野生型果蝇(遗传背景均一)中分设两组:实验组(SL)每代成虫暴露于465 nm高毒性BL(光子通量密度10.3×1018 photons·m-2·s-1)3天,筛选耐受个体(“低损伤”:恢复后仍具攀爬能力)繁殖后代;对照组(UCL)则无BL暴露(图1)。结果显示:

耐受性进化与肥胖表型的关联
经20代选择后,SL品系逐渐获得稳定耐受性:其生殖力(产蛹数/雌)在BL暴露后恢复至UCL未暴露水平(图2a),卵巢发育几乎不受抑制(图2b),且在高强度BL下的存活时间显著延长(图2d)。值得注意的是,SL果蝇在未暴露条件下即表现出独特表型:腹部膨大、体重增加(图3a,b)、脂肪体脂滴富集(图4b)及中肠显著延长(图4c),提示“肥胖”可能是耐受性的关键适应特征。


肠道微生物的核心驱动作用
表型分析表明,SL的脂质积累(脂肪酸FAMEs和TAG升高)可抵抗饥饿和氧化应激(图4e-h),但抗生素清除微生物(Abx)后,其耐受性完全丧失(图5b),体重与TAG水平亦显著下降(图5c-e)。关键证据来自“菌群移植”实验:将SL果蝇肠道内容物植入Abx处理的SL个体,可恢复其耐受性;而UCL菌群则无此效果(图5b)。进一步发现,SL肠道微生物组成虽与UCL相似(>99%为Acetobacter persici),但其丰度显著升高(图5a),且这种增殖依赖于中肠延长——中肠长度与体重呈正相关(补充图10),且SL中肠延长表型在Abx处理后仍存在(图5f),说明宿主结构改变是微生物增殖的基础。


宿主-微生物协同进化的分子基础
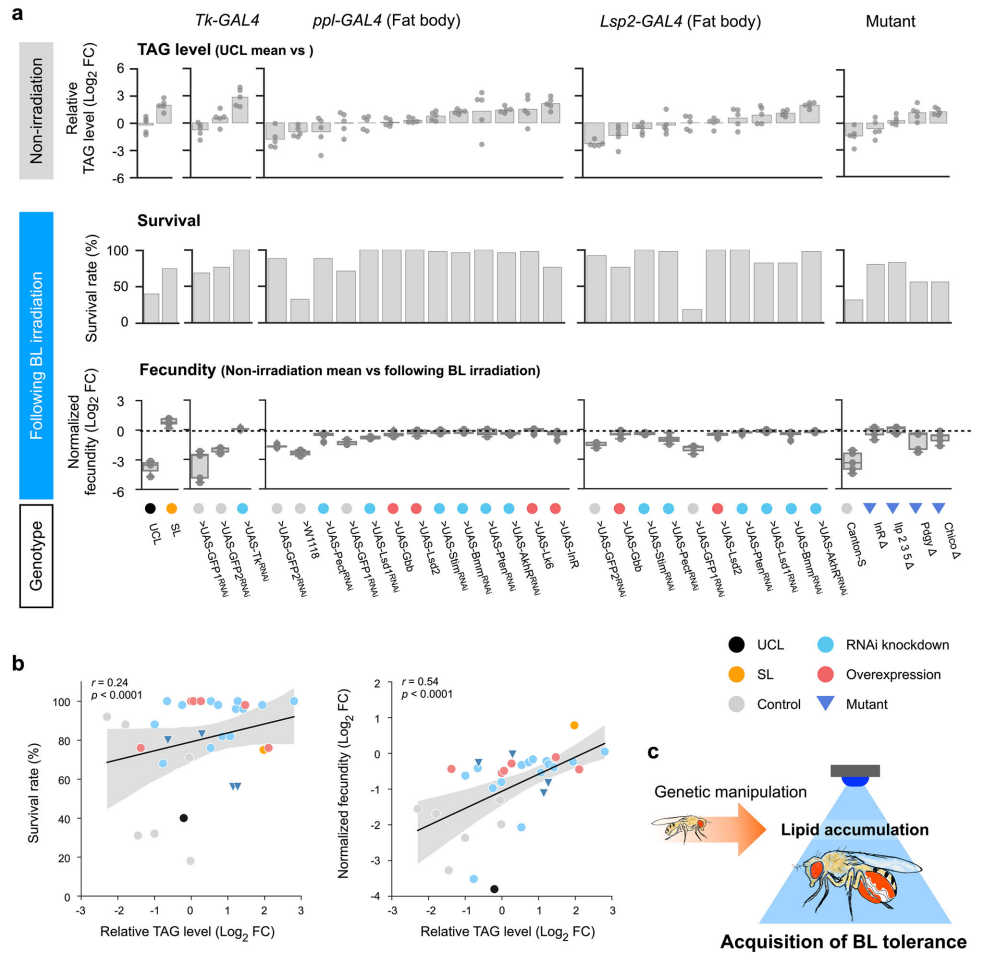
基因组分析揭示,SL品系在解毒基因(如谷胱甘肽S-转移酶GstD/GstE簇)、Hippo信号通路(调控器官大小)及免疫通路(Toll/Imd)存在特异性变异(图7)。转录组数据进一步显示,SL的线粒体代谢相关基因(如TCA循环、氧化磷酸化)普遍下调(图8c),而脂质合成相关基因表达改变(如神经肽Tachykinin, Tk的抑制)与宿主变异重叠(图8c)。值得注意的是,人为操纵脂代谢基因(如敲低Tk、AkhR或过表达InR)可模拟SL表型,显著提升BL耐受性(图9),证实脂质积累是耐受性的直接驱动力。


跨代适应与微生物功能重塑
亲代BL暴露可诱导子代中肠延长与菌群增殖(图6b,c),暗示表观遗传调控参与适应性传递。微生物层面,SL源Acetobacter persici的乙酸合成基因(ADH、乙酰-CoA水解酶)及抗氧化基因(NADPH依赖性FMN还原酶)表达上调(图10d,f),其离体生长模式亦更均一(图10g),提示BL胁迫驱动了微生物的功能适应或宿主选择偏好。

 生物通微信公众号
生物通微信公众号
知名企业招聘