
-

生物通官微
陪你抓住生命科技
跳动的脉搏
鼻内加强接种诱导持久黏膜免疫:破解SARS-CoV-2上呼吸道感染难题的小鼠研究
【字体: 大 中 小 】 时间:2025年07月08日 来源:Scientific Reports 3.8
编辑推荐:
现有COVID-19疫苗虽能预防重症,却难以阻断上呼吸道感染与病毒传播。美国国立卫生研究院团队通过创新性"肌肉注射初免+鼻内腺病毒载体加强"策略,在小鼠模型中系统比较不同接种途径的免疫效应。研究发现:鼻内加强可显著激活上呼吸道黏膜IgA抗体和组织驻留记忆T细胞(TRM),形成持久免疫屏障;而单纯肌肉注射虽诱导全身免疫,却无法提供长期上呼吸道保护。该成果为开发阻断病毒传播的新一代黏膜疫苗提供了关键理论支撑,发表于《Scientific Reports》。
背景:疫苗接种的未解难题
全球COVID-19疫苗接种已挽救数百万生命,但现有疫苗存在显著局限:肌肉注射(i.m.)的mRNA或腺病毒载体疫苗虽能有效预防重症,却难以在上呼吸道(Upper Respiratory Tract, URT)建立强效黏膜免疫屏障。这导致突破性感染频发,无法阻断病毒人际传播。随着SARS-CoV-2变异株的不断涌现,疫苗效力进一步衰减。理想的解决方案需同时满足两点:在病毒入侵门户——呼吸道黏膜建立持久防线,并克服免疫反应随时间的自然衰退。
研究策略:鼻内加强的突破性探索
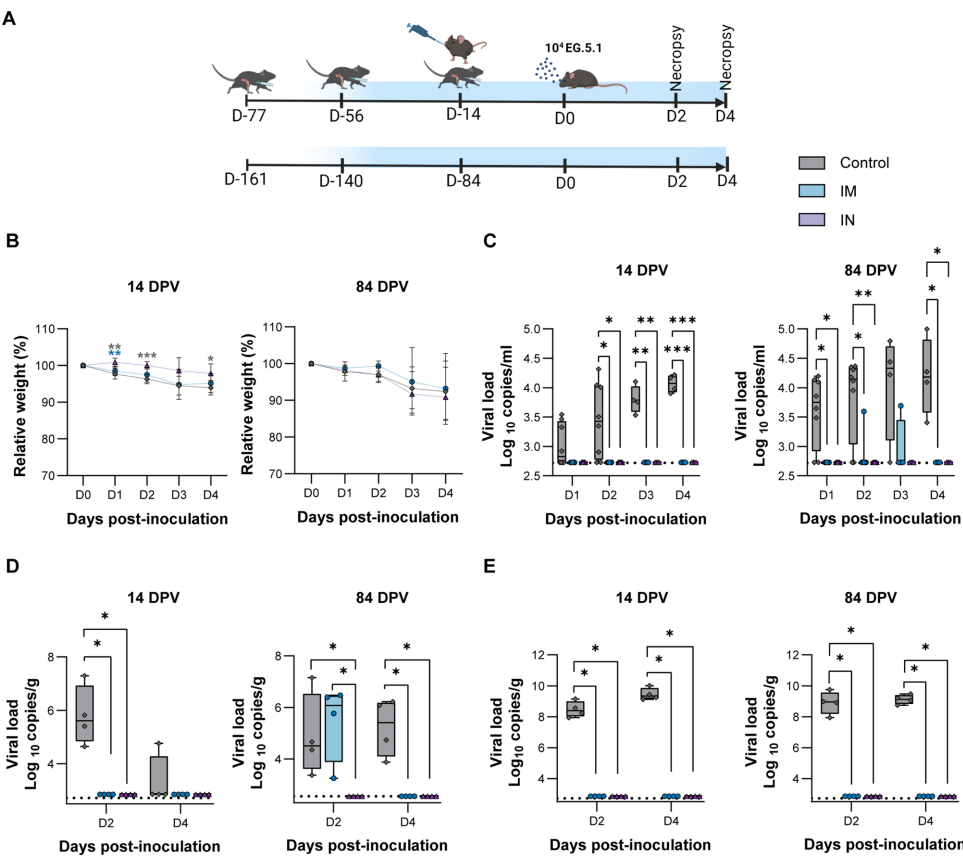
美国国立过敏与传染病研究所(NIAID)团队设计了一套精细的动物实验模型:以C57BL/6小鼠为对象,先通过两次肌肉注射mRNA疫苗(编码SARS-CoV-2刺突蛋白)建立基础免疫,六周后分为两组——一组接受第三次mRNA疫苗肌肉注射(IM组),另一组改用ChAdOx1 nCoV-19腺病毒载体疫苗鼻内接种(IN组)。研究通过多维度分析(图1实验设计)揭示不同接种途径的免疫差异:

关键技术方法
研究采用K18-hACE2转基因小鼠模拟病毒感染,通过肌肉注射(i.m.)和鼻内(i.n.)途径实施疫苗接种策略。免疫应答评估包括:
核心发现:黏膜免疫的关键优势
关键图示:IgA在黏膜屏障的核心地位

免疫细胞动态可视化

黏膜免疫枢纽的时空演变

长效保护的直接证据
黏膜免疫的分子蓝图

结论与展望:新一代疫苗的设计蓝图
本研究首次系统阐明"肌肉注射初免+鼻内腺病毒载体加强"策略的核心优势:通过定向激活上呼吸道黏膜免疫,诱导持久性IgA抗体和组织驻留记忆T细胞(TRM),实现长达12周的上呼吸道完全保护。这一发现具有三重意义:
尽管该策略在小鼠模型中效果显著,但人类转化仍面临挑战:如人体缺乏小鼠的NALT结构,且鼻黏膜屏障更复杂。近期临床试验显示,单纯鼻内腺病毒疫苗在人体效果欠佳,提示需优化递送系统或添加佐剂。未来研究可探索三方面:跨变异株保护能力、不同疫苗平台组合效应,以及TRM维持机制。正如作者所强调:"在病毒入侵门户建立防线,是终结大流行的关键。" 这项研究不仅为COVID-19疫苗升级提供路线图,更为呼吸道传染病防控开辟了新范式。
 生物通微信公众号
生物通微信公众号
知名企业招聘