
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:细胞衰老及其他年龄相关机制在骨骼疾病中的作用
【字体: 大 中 小 】 时间:2025年07月08日 来源:Bone Research 14.3
编辑推荐:
这篇综述系统阐述了细胞衰老及其衰老相关分泌表型(SASP)在骨质疏松(OP)、骨关节炎(OA)、椎间盘退变(IVDD)等骨骼疾病中的核心作用,揭示了靶向清除衰老细胞或恢复细胞活力的治疗潜力。文章创新性地提出衰老微环境中BMSCs、OBs、OCs等细胞的交互网络,并详细分析了Keap1/Nrf2、mTORC1、TGF-β/Smad等关键通路,为抗衰老治疗提供了多靶点干预策略。
骨骼作为代谢活跃的持续重塑组织,其衰老过程伴随着细胞功能紊乱和微环境失衡。研究表明,衰老细胞积累和SASP因子释放是驱动年龄相关性骨骼疾病的核心机制。在65岁以上人群中,骨骼疾病已成为致残的首要因素,揭示其分子机制对开发新型抗衰老疗法至关重要。
骨髓间充质干细胞(BMSCs)
衰老的BMSCs表现出成骨分化能力下降和脂肪化倾向。单细胞测序发现Fgfr3-creER+和Lepr-cre+亚群随年龄发生显著改变,而CXCL12+LepR+细胞向脂肪谱系分化。表观遗传学分析显示,衰老BMSCs中H3K4me1修饰增加而SOX5表达降低,线粒体功能障碍通过ROS爆发进一步加剧衰老。

成骨细胞(OBs)
CD24+和Osteolectin+OBs表现出典型衰老特征。mTORC1通过Scn1a通道引起Ca2+内流激活NFAT/ATF3/p53通路,而METTL3缺失导致Hspa1a mRNA稳定性下降。衰老OBs分泌的SHN3通过抑制SLIT3表达阻碍H型血管形成。
破骨细胞(OCs)
衰老微环境中RANKL/OPG比例失衡导致OCs过度活化。有趣的是,OCs来源的ANG通过PLXNB2介导的rRNA转录延缓内皮细胞衰老,而SPP1缺失则损害BMSCs的TGFβ1/SMAD3信号传导。
骨细胞(OCYs)
占骨骼细胞90%的OCYs衰老后线粒体自噬相关基因Atg7/Map1lc3a表达降低, perilacunar/canalicular重塑(PLR)功能受损。衰老OCYs分泌的TPM1缺失外泌体显著抑制BMSCs成骨分化。
软骨细胞
circRREB1通过miR-182-5p/SIRT1轴调控衰老,而PDZK1缺失导致机械应力诱导的线粒体功能障碍。衰老软骨细胞分泌的EVs富含miR-34a/miR-24/miR-150,通过旁分泌加速邻近细胞衰老。

间充质干细胞
m6A去甲基酶ALKBH5下调导致CYP1B1 mRNA稳定性增加,而HP1α/LAP2核纤层蛋白缺失促进炎症。Gremlin 1+细胞耗竭被发现是软骨退变的关键因素。
滑膜细胞
衰老滑膜成纤维细胞通过PI3K/ERK通路分泌促炎脂肪因子,而CD38+巨噬细胞通过NAD+耗竭加速衰老进程。
髓核细胞(NPCs)
机械敏感通道Piezo1过表达引发线粒体功能障碍,cGAS/STING轴异常激活导致DNA损伤相关衰老。Keap1/Nrf2/Wnt5a信号轴被证实具有保护作用,而自噬受体NLRX1缺失会诱发过度线粒体自噬。
纤维环细胞(AFCs)
SHH信号衰减导致细胞极性丧失,CD133+/Notch1+干细胞标志物表达下降显著削弱组织修复能力。
软骨终板细胞(CEPCs)
Hippo-CCL3信号激活异常应力诱导的OC分化,而衰老巨噬细胞分泌IL-10通过STAT3通路促进终板硬化。
四种抗衰老策略展现出临床潜力:
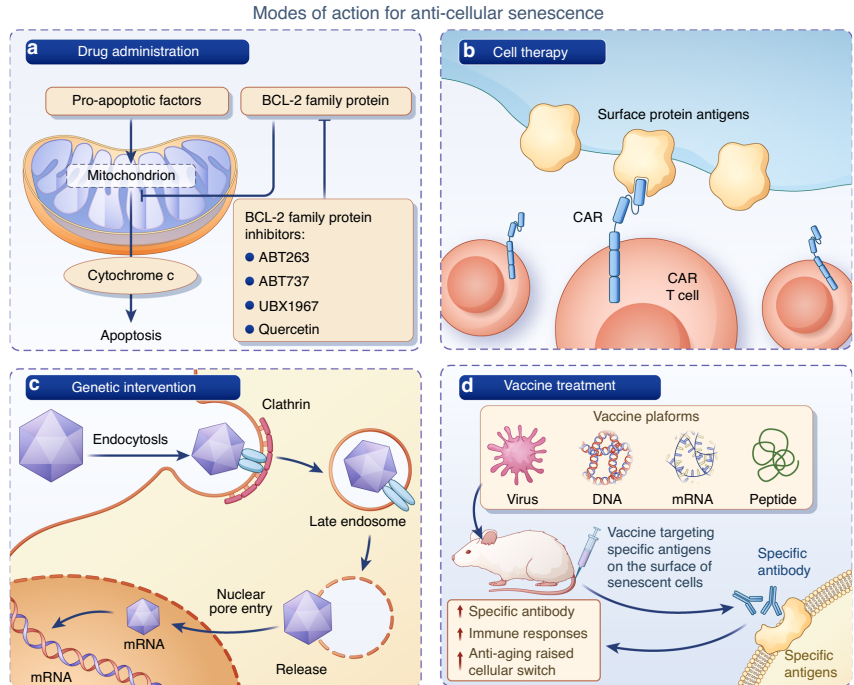
骨骼系统的衰老呈现多细胞、多通路的网络特征。未来研究需聚焦:①SASP在器官间传递的分子机制;②衰老生物标志物的精准鉴定;③个性化抗衰老方案的优化。通过整合"骨-肌肉-神经"轴的多器官调控机制,有望开发出改善老龄人群生活质量的创新疗法。
 生物通微信公众号
生物通微信公众号
知名企业招聘