
-

生物通官微
陪你抓住生命科技
跳动的脉搏
麻疹病毒聚合酶复合体非核苷抑制剂的结构解析与变构抑制机制
【字体: 大 中 小 】 时间:2025年07月08日 来源:Cell 45.5
编辑推荐:
上海科技大学等机构的研究人员通过冷冻电镜技术解析了麻疹病毒(MeV)聚合酶复合体(L-P)在apo状态及非核苷抑制剂(ERDRP-0519/AS-136A)结合状态下的高分辨率结构,揭示了抑制剂通过诱导GDN环构象变化实现变构抑制的分子机制,并发现ERDRP-0519对尼帕病毒(NiV)聚合酶具有交叉抑制作用,为开发广谱抗副黏病毒药物提供了新靶点。
麻疹病毒(Measles virus, MeV)作为副黏病毒科(Paramyxoviridae)中传染性最强的病原体之一,每年导致全球超千万感染病例,尽管疫苗已广泛应用,但接种率下降和免疫失败仍造成近年疫情反弹。更严峻的是,其近亲尼帕病毒(Nipah virus, NiV)致死率高达70%,两者均缺乏特效抗病毒药物。病毒聚合酶复合体由大蛋白(L)和磷酸蛋白(P)组成,是抗病毒研发的关键靶点,但长期以来其精确结构和抑制机制不明,严重阻碍了药物开发。
上海科技大学的研究团队在《Cell》发表重要成果,首次解析了MeV聚合酶复合体在天然状态及两种非核苷抑制剂(ERDRP-0519和AS-136A)结合状态下的冷冻电镜结构,分辨率达3.0-3.4 ?。研究采用昆虫细胞共表达系统纯化L-P复合体,通过表面等离子共振(SPR)验证抑制剂结合活性,结合体外转录实验和冷冻电镜结构解析,系统阐明了变构抑制机制。
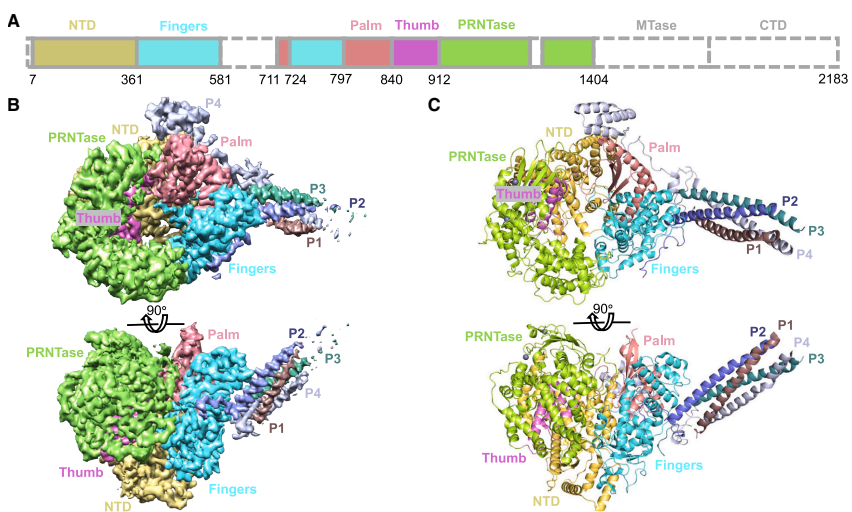
整体结构特征
通过3.0 ?冷冻电镜结构揭示MeV-L蛋白包含NTD、RdRp和PRNTase三个可见结构域,其中RdRp呈现经典的"手指-掌-拇指"折叠构象。P蛋白通过α螺旋四聚化形成束状结构与L蛋白相互作用。

抑制剂结合模式
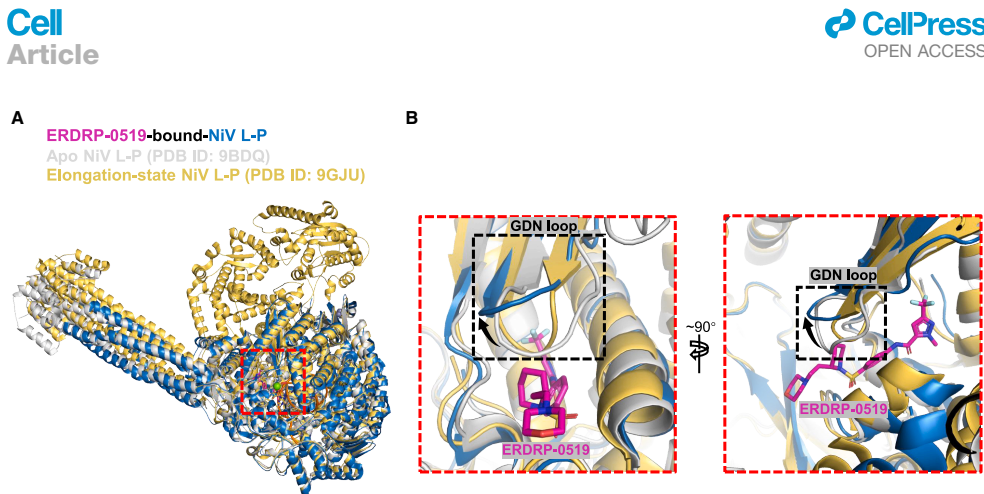
ERDRP-0519结合在RdRp催化中心附近的变构口袋,其吡唑环和三氟甲基与Leu664、Tyr667等疏水残基形成关键相互作用,并通过氢键网络稳定结合。结构比对发现抑制剂诱导催化环(GDN loop)发生2.3 ?位移,使其从活性"GDN-in"状态转变为失活"GDN-out"构象。
变构抑制机制
抑制剂通过锁住GDN环阻碍镁离子(Mg2+)与核苷三磷酸(NTP)的配位,破坏病毒RNA合成必需的"双金属离子机制"。该发现解释了临床耐药突变(T751Y)导致60倍亲和力下降的结构基础。

跨物种抑制发现
基于结构相似性,研究发现ERDRP-0519能以更高亲和力结合NiV聚合酶,体外转录实验证实其显著抑制NiV RNA合成。3.0 ?冷冻电镜结构显示NiV中Glu799与哌啶环的额外氢键解释了更强的抑制效果。
这项研究首次揭示了副黏病毒聚合酶的变构抑制机制,为开发广谱抗病毒药物提供了关键结构基础。特别值得注意的是,口服生物可利用的ERDRP-0519已通过临床前动物实验验证,其双重抑制特性为应对MeV和NiV这类高致病性病毒提供了全新治疗策略。研究成果不仅解决了长期困扰该领域的关键科学问题,更为理性药物设计提供了精确的分子蓝图,对全球传染病防控具有重大意义。
 生物通微信公众号
生物通微信公众号
知名企业招聘