
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:肿瘤源性外泌体及其在癌症治疗中的应用
【字体: 大 中 小 】 时间:2025年07月09日 来源:Journal of Translational Medicine 6.1
编辑推荐:
这篇综述系统阐述了肿瘤源性外泌体(TDEs)在癌症进展中的双重作用:既作为促肿瘤转移的媒介传递生物活性分子(如miRNA、VEGF),又作为新型诊疗载体通过工程化改造实现靶向给药(如CRISPR/Cas9递送)。文章重点探讨了TDEs调控肿瘤微环境(TME)、血管生成和免疫逃逸的机制(涉及PD-L1/PD-1通路),并分析了其作为液体活检标志物和药物递送系统的临床转化潜力。
肿瘤源性外泌体(TDEs)是直径30-150纳米的细胞外囊泡,由癌细胞分泌至血液、尿液等体液中。这些纳米级载体携带蛋白质、脂质、RNA和DNA等分子,通过细胞间通讯重塑肿瘤微环境(TME),促进血管生成、免疫抑制和转移。值得注意的是,TDEs表面标志物(如CD63、CD81)和内容物(如miR-21、VEGF)具有肿瘤特异性,使其成为癌症诊断的"液体活检"标志物和治疗的靶向递送工具。
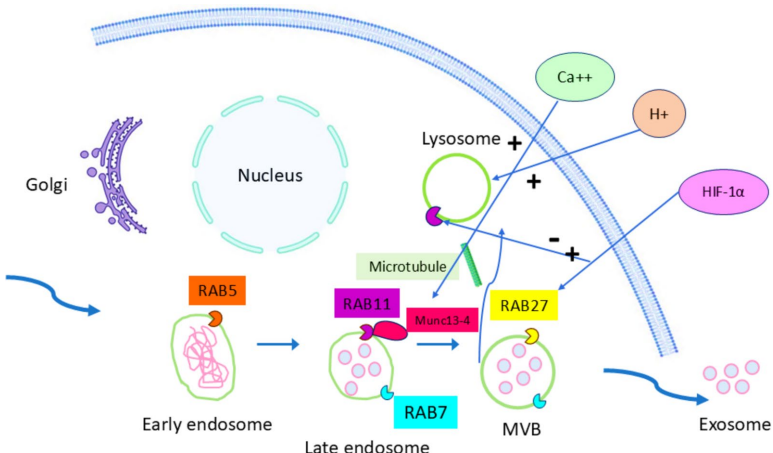
生物发生与分泌
TDEs通过内体途径形成:早期内体→多泡体(MVBs)→与质膜融合释放。这一过程依赖ESCRT复合体和Rab GTP酶(如Rab27a/b),而肿瘤低氧和酸性环境会异常激活外泌体分泌。
分子组成
促肿瘤作用
诊断价值
工程化改造
技术挑战

通过微流控芯片整合外泌体分离与检测(如SERS技术),结合人工智能分析外泌体组学数据,将加速个体化医疗发展。目前全球已有8项TDEs相关疗法进入临床试验,涵盖卵巢癌、黑色素瘤等适应症。
 生物通微信公众号
生物通微信公众号
知名企业招聘