
-

生物通官微
陪你抓住生命科技
跳动的脉搏
光控可逆生物分子凝聚体RELISR实现活体细胞和动物中蛋白质与mRNA的时空精准调控
【字体: 大 中 小 】 时间:2025年07月09日 来源:Nature Communications 14.7
编辑推荐:
本研究针对生物分子凝聚体人工操控工具匮乏的难题,开发了光控可逆存储释放系统RELISR。韩国科学技术院(KAIST)团队通过整合多价支架蛋白、光遗传开关PixD/PixE和货物结合域,构建了能时空精确控制蛋白质活性和mRNA翻译的平台。该系统在黑暗状态下形成稳定凝聚体高效捕获靶标,蓝光照射时快速释放功能蛋白(如Vav2、Rac1等)和mRNA,成功调控了神经元形态和活体小鼠的基因翻译,为研究细胞信号传导和基因治疗提供了创新工具。
在生命活动的精密调控中,细胞通过无膜结构的生物分子凝聚体(biomolecular condensates)高效组织生化反应。这些由多价支架蛋白动态组装形成的"液态隔间",既能作为信号传导的枢纽,又可充当生物分子的存储仓库。然而科学家们长期面临一个关键瓶颈:如何像操控开关般精确控制这些凝聚体的形成与解体?现有工具要么缺乏靶向特异性,要么无法同时操控蛋白质和核酸,严重制约了对相分离现象的深入研究及其应用开发。
韩国科学技术院(KAIST)的Won Do Heo团队在《Nature Communications》发表的突破性研究,带来了名为RELISR(Reversible Light-Induced Store and Release)的光控可逆存储释放系统。这个精巧的分子装置融合了三种核心元件:形成多价支架的寡聚化蛋白(如四聚体DsRed)、蓝光敏感的PixD/PixE异源寡聚系统,以及特异性结合靶标的纳米抗体(VHHGFP)或MS2衣壳蛋白(tdMCP)。通过系统优化各模块的化学计量比,研究人员成功构建出在黑暗条件下自发组装、蓝光照射时快速解离的人工凝聚体平台。
关键技术路线包含四个关键环节:(1)基于PixD10-PixE4超分子复合体的光响应骨架设计;(2)通过荧光漂白恢复(FRAP)实验验证凝聚体稳定性;(3)采用荧光原位杂交(FISH)追踪mRNA定位;(4)建立活体小鼠模型验证光控基因表达。实验样本涵盖HeLa细胞、原代海马神经元和BALB/c小鼠等多层次模型。
通过系统筛选12种不同价态组合,发现DsRed-PixD(四聚体)与SNAPtag-PixE(单体)的组合兼具高簇形成率(85.7%)和优异的光响应性(95.57%)。局部光照实验显示,特定凝聚体可在24秒内完全解离,释放的组分扩散至胞质而非发生光漂白。
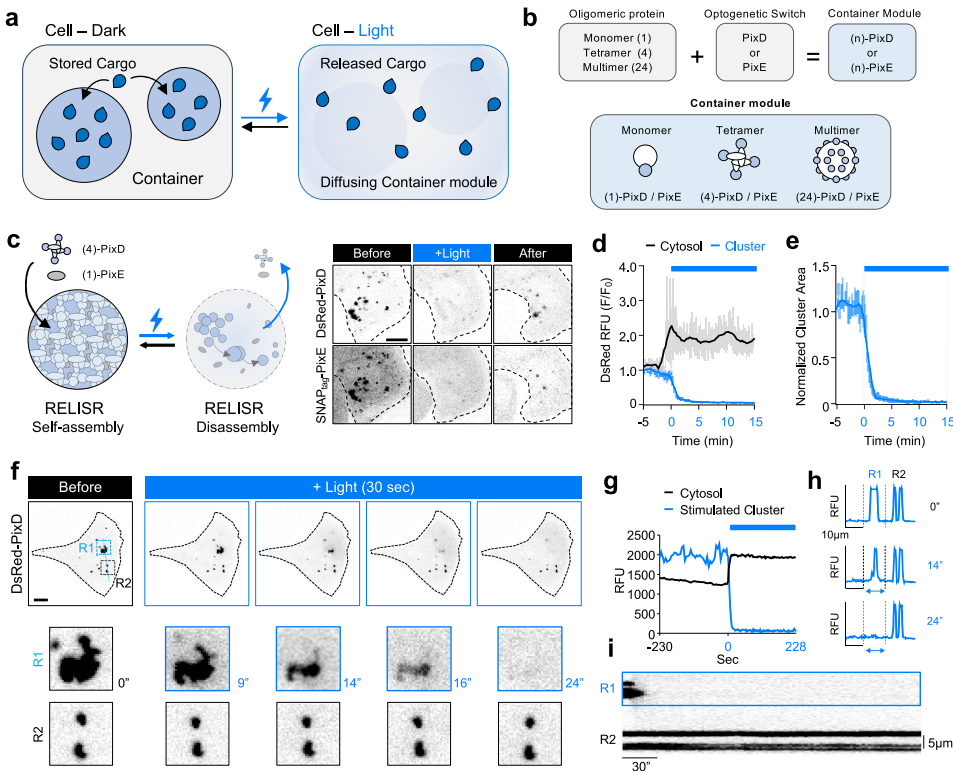
GFP纳米抗体修饰的Protein-RELISR对单体EGFP的捕获效率(Pearson系数0.9574)显著高于多聚体EGFP-AD(0.8797)。有趣的是,串联双纳米抗体(VHHGFP×2)显著提升了对十二聚体EGFP-AD的捕获效率。FRAP实验证实凝聚体流动性仅4.4%,确保货物分子的稳定存储。
在原代海马神经元中,RELISR成功实现亚细胞区室的精确调控。局部光照胞体区域后,刺激区域EGFP信号下降82.6%(F25/F0=0.174),而相邻区域因扩散效应增加40.7%。

在NIH3T3成纤维细胞中,光控释放Vav2(RhoGEF)使细胞圆形度增加1.3倍(P=0.0459)。类似地,Rac1、Cdc42等Rho GTP酶的释放均引发显著形态变化。PTEN-GFP的局部释放更导致PI(3,4,5)P3水平下降16.9%,证实信号通路的精确调控。
针对含24个MS2结合位点(MBS)的CFP-mRNA,tdMCP修饰的mRNA-RELISR使其翻译效率降低67%(P=0.0002)。免疫印迹显示光照后CFP表达量增加71.6%(P=0.0059)。活体实验中,光激活组小鼠的荧光素酶信号是对照组的8.5倍。

这项研究突破了传统相分离操控工具的局限性,首次实现活体水平蛋白质与mRNA的双重调控。相较于线粒体定位的LOVTRAP系统(仅改变mRNA空间分布),RELISR通过物理隔离机制更有效抑制翻译活性。该平台为研究神经元突触可塑性、肿瘤细胞迁移等过程提供了分子开关,其模块化设计更可适配CRISPR等基因编辑工具,为时空精确的基因治疗开辟新途径。研究者特别指出,虽然当前使用穿透深度有限的蓝光系统,未来整合红光调控元件将进一步提升其在深层组织中的应用潜力。
 生物通微信公众号
生物通微信公众号
知名企业招聘