
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:线粒体在肾缺血再灌注损伤中的作用研究进展
【字体: 大 中 小 】 时间:2025年07月10日 来源:Clinical and Experimental Nephrology 2.2
编辑推荐:
这篇综述系统阐述了线粒体在肾缺血再灌注损伤(RIRI)中的核心作用,聚焦于线粒体生物合成(PGC-1α)、动力学(DRP1/OPA1/MFN2)、自噬(PINK1/Parkin、BNIP3/FUNDC1)和能量代谢异常的关键机制,并总结了靶向调节线粒体功能的药物(如Metformin、Empagliflozin)和天然成分(如白藜芦醇、灵芝多糖肽)的治疗潜力,为临床防治急性肾损伤(AKI)提供了新思路。
肾缺血再灌注损伤(RIRI)是急性肾衰竭的主要诱因,其病理机制与线粒体功能障碍密切相关。线粒体作为能量代谢和信号转导的核心细胞器,在缺血缺氧条件下易发生结构异常(如嵴断裂、膜电位下降)和功能紊乱(ATP合成减少、ROS暴发),进而触发氧化损伤、钙超载和细胞凋亡级联反应。
肾小管上皮细胞(TECs)富含线粒体,依赖脂肪酸β-氧化维持溶质转运。RIRI中,线粒体15分钟内即可出现碎片化,伴随膜电位崩溃和ATP耗竭。

过氧化物酶体增殖物激活受体γ共激活因子1α(PGC-1α)是线粒体生物合成的核心调控因子。RIRI通过炎症因子(TNF-α/IL-1β)抑制PGC-1α表达,导致NAD+合成障碍和能量危机。激活PGC-1α可促进线粒体DNA(mtDNA)复制,改善AKI预后。
分裂与融合:动力相关蛋白1(DRP1)介导过度分裂会加速细胞凋亡,而MFN2和OPA1促进融合可维持线粒体网络完整性。SIRT3通过ERK-OPA1通路增强融合,TRIM35则通过抑制TIGAR泛素化保护线粒体功能。
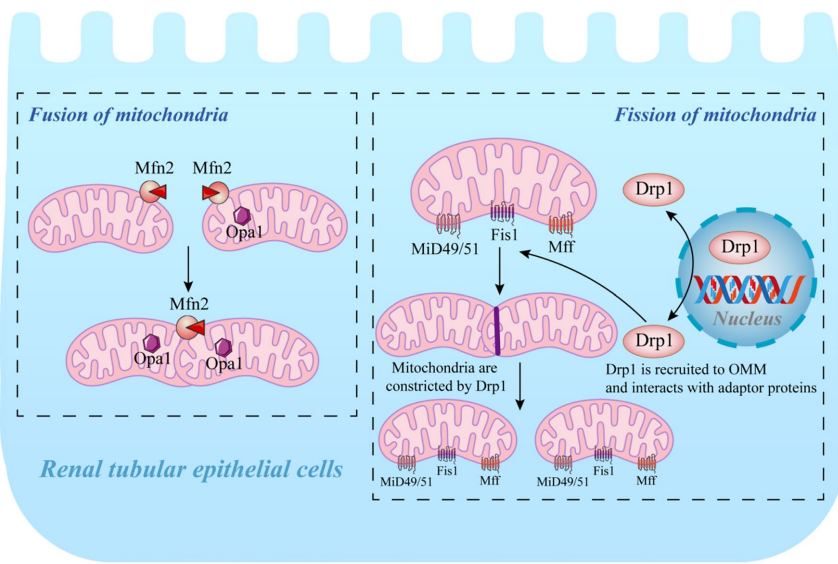
自噬调控:PINK1/Parkin通路通过泛素化标记损伤线粒体,而受体蛋白(BNIP3/NIX/FUNDC1)直接结合LC3启动选择性自噬。HIF-1α/FUNDC1轴在缺氧时增强自噬流,但过度激活可能导致二次损伤。

药物干预:
天然成分:

未来需探索时空特异性调控线粒体自噬的手段,如小分子药物联合基因编辑技术,以平衡保护性与损伤性自噬的临界阈值,为RIRI的精准治疗提供新范式。
 生物通微信公众号
生物通微信公众号
知名企业招聘