
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:编码序列中的m6A:连接沉积、翻译与衰变的调控机制
【字体: 大 中 小 】 时间:2025年07月10日 来源:TRENDS IN Genetics 13.6
编辑推荐:
这篇综述深入探讨了mRNA内部最丰富的修饰——N6-甲基腺苷(m6A)在编码序列(CDS)中的动态调控作用,揭示了其通过外显子连接复合体(EJC)限制性沉积、触发翻译依赖性降解(CMD)的新机制,并阐明了该通路在癌症等疾病中的潜在治疗价值。文章创新性提出m6A的时空特异性调控网络,为RNA代谢研究提供了重要范式。
RNA生命周期从转录起始到降解终结,其动态周转过程受到m6A这一最丰富内部修饰的精密调控。作为表观转录组学的关键标记,m6A通过影响剪接、核输出及稳定性等环节塑造mRNA命运。特别值得注意的是,编码序列(CDS)区域的m6A修饰展现出独特的降解信号功能,其效率显著高于非翻译区(UTR)位点。
m6A沉积遵循DRACH序列偏好性(D=A/G/U, R=A/G),由METTL3/METTL14甲基转移酶复合体催化完成。研究发现外显子连接复合体(EJC)通过空间位阻效应抑制剪接位点邻近区域的甲基化,形成特征性的m6A分布模式——主要富集于长内部外显子和终止密码子附近。这种"默认甲基化-局部抑制"模型通过深度学习预测得到验证:外显子-内含子边界特异性降低相邻外显子的m6A沉积。
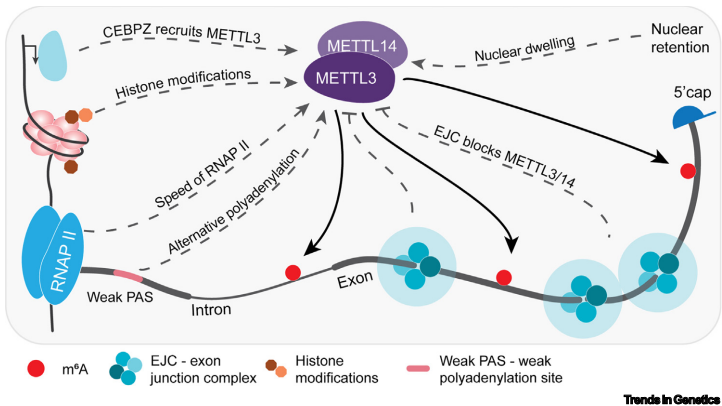
沉积时相研究揭示m6A存在共转录与转录后双阶段修饰:初期低化学计量比均匀分布,后期经EJC引导形成成熟mRNA的特征模式。单分子测序技术dFORCE证实,剪接前的RNA已呈现外显子连接处m6A缺失,暗示除EJC外还存在其他调控因子。值得注意的是,RNA聚合酶II(RNAP II)延伸速度与m6A沉积效率呈负相关——减速的RNAP II使新生链二级结构减少,更易暴露甲基化位点。
CDS区域m6A触发的新型降解途径(CMD)展现出两大特征:
结构生物学研究揭示,m6A的6-甲基基团可能干扰tRNA-mRNA配对,而tRNA修饰mcm5s2U可缓解这种效应。在癌症中该修饰的缺失会加剧核糖体碰撞,显著增强CMD活性。这种修饰间互作(m6A-mcm5s2U轴)为肿瘤特异性调控提供了新视角。

CMD靶标在加工小体(P-bodies)显著富集,这种相分离形成的无膜细胞器可能作为降解执行场所。研究观察到:
但P-body在CMD中究竟发挥主动降解还是临时存储功能,仍需进一步解析。单细胞研究显示其mRNA组成具有细胞周期依赖性,暗示m6A可能参与转录本时空特异性分配。
CMD通路选择性调控具有重要生理功能的基因:
METTL3抑制剂已进入AML临床I期试验(NCT05584111),而mcm5s2U缺失肿瘤对CMD的敏感性可能成为新的治疗突破口。值得注意的是,抑癌基因(如BRCA2)的同义突变可通过破坏m6A位点导致mRNA不稳定,揭示m6A在肿瘤发生中的双重角色。
当前研究仍存在多个关键问题:
这些问题的解答将推动m6A研究从机制解析向精准医疗转化,为癌症等疾病的治疗提供新策略。
 生物通微信公众号
生物通微信公众号
知名企业招聘