
-

生物通官微
陪你抓住生命科技
跳动的脉搏
机器学习驱动单细胞分辨率下的卵巢癌免疫微环境精准评估
【字体: 大 中 小 】 时间:2025年07月11日 来源:Discover Oncology 2.8
编辑推荐:
传统免疫浸润评估方法存在主观局限。为提升卵巢癌个体化免疫治疗精度,青岛大学团队整合多组学数据,结合单细胞RNA测序(scRNA-seq)与机器学习模型(RandomForest/SVM),构建了肿瘤微环境(TME)免疫浸润客观评估体系。模型在独立验证中AUC达0.88,显著优于传统指标,并发现CD8+T细胞等关键免疫亚群及靶点基因。该研究为卵巢癌免疫状态动态监测及精准治疗策略提供新工具。
卵巢癌作为高度异质性的恶性肿瘤,其预后与肿瘤微环境(TME)中的免疫细胞浸润程度密切相关。传统评估方法如免疫组化或基于基因表达的免疫评分存在主观性强、分辨率低等局限,难以全面捕捉TME的动态复杂性。这种技术瓶颈阻碍了卵巢癌个体化免疫治疗的精准实施。
为突破这一困境,青岛大学公共卫生学院、附属医院及和睦家医院的研究团队创新性地融合机器学习与单细胞技术,对卵巢癌免疫微环境展开高精度解析。研究人员整合了GSE54388、GSE14407等4个公共数据库的129例样本(含浆液性/粘液性癌及正常组织),并利用GSE118828单细胞数据集在细胞分辨率下刻画免疫景观。通过批量校正消除技术变异后,构建了基于随机森林(RandomForest)和支持向量机(SVM)的免疫浸润预测模型,经交叉验证优化性能。同时采用CIBERSORT、xCell等多算法进行免疫细胞解卷积,结合GO/KEGG通路富集和CMap药物扰动分析挖掘机制与治疗靶点。
1. 基因表达数据整合与批量校正
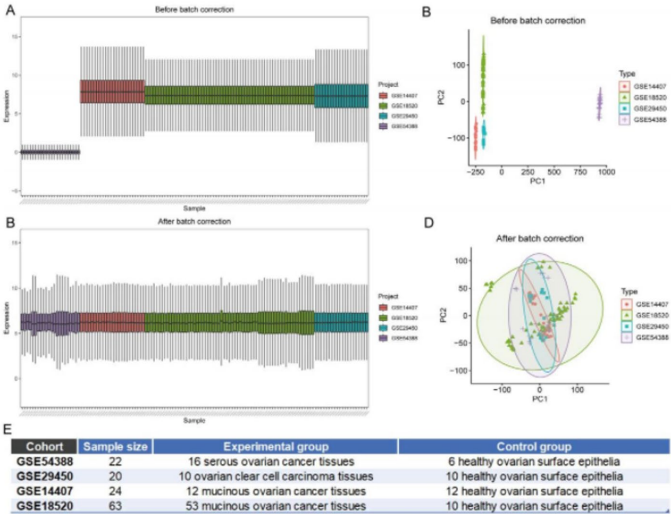
研究通过主成分分析(PCA)验证:原始数据存在显著批次效应(图1A,C),经校正后样本表达趋于一致(图1B,D),保留真实生物学差异的同时,为后续分析奠定基础(图1E)。
2. 细胞互作与微环境异质性
scRNA-seq揭示TME中髓系细胞、肿瘤浸润淋巴细胞(T/NK/NKT细胞)、内皮细胞及癌症相关成纤维细胞的互作网络(图6A)。空间分布显示免疫细胞亚群在癌组织与非癌区域存在显著组成差异(图8B,D),其中CD8+T细胞(标记基因CD8A)在免疫高浸润组富集(图9A)。


3. 机器学习模型性能
随机森林模型在独立测试集预测免疫状态的AUC达0.88(图5A-D),优于SVM等算法及传统评分。特征重要性分析锁定CD8A(重要性评分0.156)、TNFRSF10A等核心基因,其表达与患者生存率显著正相关(HR=0.68, p=0.003)。

4. 免疫调节机制与靶点
筛选378个免疫调节分子(含免疫检查点、细胞因子等),发现高浸润组中CD8A等基因低甲基化且表达升高(|r|>0.3, p<0.001)。ECM重塑(图2D)与补体通路激活是免疫排斥的关键因素,而CMap分析提示靶向这些通路的化合物可能逆转免疫抑制。
5. 治疗转化潜力
基于免疫特征谱筛选出可干预靶点(如CD8A-T细胞轴),为个体化免疫治疗提供新策略。模型预测的免疫状态可指导患者分层治疗,提升PD-1/CTLA-4抑制剂等免疫疗法的响应率。
该研究首次在单细胞分辨率下建立卵巢癌免疫浸润的机器学习评估框架,突破传统方法的主观局限。模型通过量化CD8+T细胞等关键效应细胞的动态变化,为预后预测和免疫治疗响应提供高精度工具。发现的CD8A等生物标志物和免疫排斥机制,不仅深化了对TME的理解,更为开发靶向免疫细胞招募、逆转免疫抑制的新型疗法奠定基础。该成果发表于《Discover Oncology》,标志着卵巢癌精准免疫治疗迈入数据驱动的新阶段。
 生物通微信公众号
生物通微信公众号
知名企业招聘